
BREAST CANCER BRAIN METASTASIS : A COMPREHENSIVE REVIEW.
Raghavendra AS, Ibrahim NK.
JCO Oncol Pract. 2024 Oct;20(10):1348-1359. doi: 10.1200/OP.23.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/38748968
Il carcinoma mammario rappresenta, dopo il tumore polmonare, la neoplasia che più frequentemente metastatizza all’encefalo. L’incidenza di metastasi cerebrali è aumentata nel tempo per il miglioramento della qualità degli esami diagnostici e per l’aumentata efficacia dei trattamenti antitumorali, con conseguente più lunga sopravvivenza di pazienti che possono quindi sviluppare metastasi cerebrali.
Attualmente, le metastasi cerebrali vengono diagnosticate nel 15-30% delle pazienti con carcinoma mammario invasivo (Leone JP, 2021) e, nelle pazienti metastatiche, i tassi di metastasi cerebrali sono differenti nei vari sottotipi tumorali: 28,7% nei tumori HR-/HER2+; 22% nei Triplo Negativi; 15,4% nei HR+/HER2+; 10,8% nei tumori Luminal B e 7,6% nei Luminal A (Kennecke H, 2010).
Poiché la diagnosi di metastasi cerebrali è generalmente associata a un impatto negativo sulla sopravvivenza e sulla qualità di vita dei pazienti, è importante un periodico aggiornamento sulla gestione delle pazienti, sui trattamenti disponibili e sui numerosi studi clinici in corso.
COMMENTO a cura di Stefania Gori- IRCCS Sacro Cuore Don Calabria, Negrar di Valpolicella (VR)
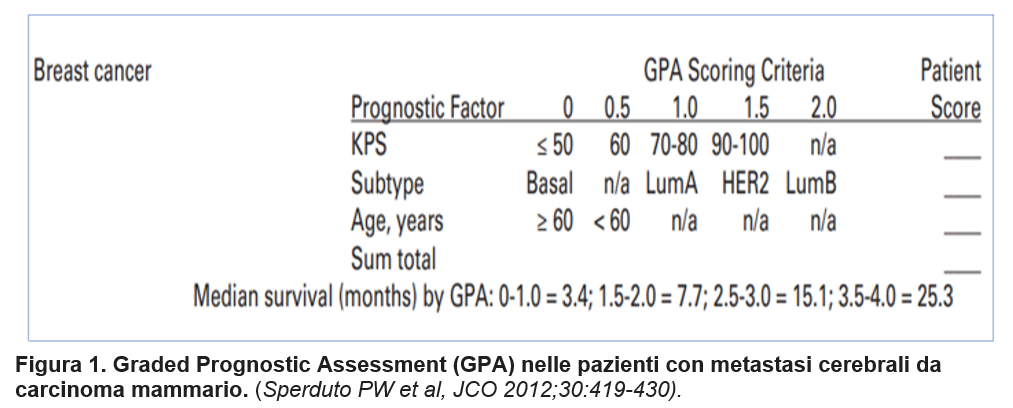
In presenza di sintomi sospetti per metastasi cerebrali (da ipertensione endocranica-cefalea, nausea e vomito, alterazioni psichiche- e/o da compromissione delle strutture nervose adiacenti) deve essere eseguita una TC con mdc e poi una Risonanza magnetica con mdc che fornisce informazioni più dettagliate rispetto alla TC sulle dimensioni, numero e distribuzione delle metastasi. Il sottotipo tumorale influenza sia la sopravvivenza globale mediana delle pazienti trattate per metastasi cerebrali (14 mesi nei TN, 18 mesi nei tumori HER2+ e 34 mesi nei tumori luminali) (Darlix A, 2019; Shen Q, 2015; Witzel I, 2018) sia la causa di morte: le pazienti HER2+ muoiono più frequentemente per progressione cerebrale e le pazienti con tumori TN per progressione della malattia extracranica (Dawood S, 2013). Lo sviluppo di modelli prognostici, che hanno valutato età, Performance Status secondo Karnosky e sottotipo tumorale (Figura 1), ha permesso inoltre di avere a disposizione strumenti che possono dare indicazioni sulla diversa sopravvivenza mediana delle pazienti con metastasi cerebrali ed essere quindi utili sia ai fini della decisione terapeutica nella singola paziente che del disegno di studi clinici (Sperduto PW, 2012).
Il trattamento delle metastasi cerebrali è basato su un approccio multimodale che include terapia sintomatica (steroidi per il controllo dell’edema perilesionale e farmaci antiepilettici, da iniziare dopo la comparsa di una crisi epilettica), trattamento locale (chirurgia, SRS, WBRT) e terapia sistemica antitumorale.
Trattamento locale delle metastasi cerebrali
La scelta del trattamento locale (chirurgia e/o radioterapia) dipende dai fattori prognostici della singola paziente e dal diametro, numero e sedi delle metastasi cerebrali. La WBRT ha rappresentato lo standard di trattamento delle metastasi cerebrali negli anni ’70 con OS mediana di circa 4-5 mesi. La chirurgia può avere un ruolo nella lesione cerebrale singola situata in sede accessibile in presenza di fattori prognostici favorevoli. Dei tre studi randomizzati condotti per confrontare WBRT+ chirurgia rispetto a sola WBRT, due hanno riportato una OS mediana significativamente superiore quando la WBRT è stata associata alla chirurgia rispetto a sola WBRT: 9,2 mesi vs 3,5 mesi ( p<0,01) nello studio di Patchell (Patchell RA,1990); 10 mesi vs 6 mesi (p=0,04) nello studio di Vecht (Vecht CJ,1993).
La SRS (Stereotactic RadioSurgery), metodica che permette di erogare elevate dosi di radiazioni su un zona circoscritta (utilizzando un acceleratore lineare o una gamma-Knife) eliminando in maniera efficace la malattia macroscopica e minimizzando il danno ai tessuti sani circostanti, rappresenta un’opzione terapeutica per la malattia cerebrale oligometastatica. A differenza della WBRT, la SRS può inoltre essere ripetuta per trattare nuove metastasi in altre regioni cerebrali senza aumento degli effetti avversi.
Le linee guida ASCO-SNO-ASTRO 2021 raccomandano la SRS per il trattamento di 1-4 metastasi cerebrali non resecabili e nel trattamento post-operatorio di pazienti sottoposte a resezione di 1-2 metastasi cerebrali (Vogelbaum MA, 2021).
Tuttavia, l’uso di SRS si è ampliato oltre queste indicazioni e può rappresentare una opzione per pazienti selezionati che hanno fino a 10 lesioni cerebrali (Yamamoto M, 2014), con studi in cui sono stati trattati pazienti fino ad oltre 10-15 lesioni. Va sottolineato che la SRS ha dei limiti rispetto alla WBRT o alla chirurgia. La SRS può essere meno efficace nel trattamento di lesioni cerebrali >3cm, potrebbe richiedere settimane/mesi per ottenere una risposta e una riduzione dei sintomi, potrebbe determinare complicanze acute (nausea, vomito, cefalea, deficit cognitivi a breve termine) e radionecrosi (10% dei casi). Inoltre, rispetto alla chirurgia, la SRS non permette di avere una conferma patologica e, rispetto alla WBRT, potrebbe lasciare non trattate alcune micrometastasi.
In uno studio retrospettivo (Prabhu RS, 2017), la resezione chirurgica seguita da SRS ha evidenziato una sostanziale riduzione della ripresa locale rispetto alla sola SRS, soprattutto in pazienti con due o più di 2 lesioni cerebrali (36,7% vs 20,5%; p=0,007) e un maggior tasso di OS a 2 anni (38,9% vs 19,8%; p=0,01).
La SRS seguita da WBRT potrebbe essere presa in considerazione in casi selezionati per ridurre il tasso di sviluppo di nuove metastasi cerebrali nelle aree non sottoposte a SRS.
Qualora la SRS non sia perseguibile per numero e dimensioni delle metastasi cerebrali, la WBRT rappresenta l’opzione di scelta, preferibilmente con risparmio dell’ippocampo per limitare le sequele neurocognitive a medio-lungo termine.
Trattamento sistemico delle metastasi cerebrali
Nella malattia metastatica HER2+, in presenza di metastasi cerebrali, sono disponibili vari agenti anti-HER2: trastuzumab+pertuzumab; TDM-1; tucatinib in associazione a capecitabina e trastuzumab; Trastuzumab deruxtecan; lapatinib. In caso di progressione cerebrale ma con controllo di malattia extracranica, il trattamento sistemico in corso non richiede di essere modificato.
Il trastuzumab, dopo somministrazione endovenosa, presenta bassi livelli, non terapeutici, nel liquido cefalo-rachidiano, che tuttavia possono aumentare dopo distruzione della barriera ematoencefalica (che può verificarsi per carcinomatosi leptomeingea o dopo radioterapia): questo supporta il mantenimento del trastuzumab (+/- pertuzumab) dopo comparsa di metastasi cerebrali in presenza di malattia extra-cranica ancora responsiva al trattamento.
Tra gli altri farmaci, lapatinib, un inibitore orale tirosin-chinasico di HER2 e EGFR, ha evidenziato nello studio di fase II a braccio singolo LANDSCAPE, in associazione a capecitabina, un 66% di risposte obiettive volumetriche cerebrali tra le 44 pazienti arruolate (Bachelot T,2013).
Il TDM-1 (trastuzumab-emtansine), attualmente rimborsato da AIFA in Italia nelle pazienti con carcinoma mammario metastatico con progressione di malattia dopo una linea di trattamento con agente anti-HER2 o nei 6 mesi dal completamento di terapia adiuvante, è stato valutato anche nello studio internazionale di fase IIIb KAMILLA a singolo braccio. Lo studio ha arruolato 2002 pazienti metastatiche in progressione e candidate a ricevere TDM-1 e ha evidenziato risultati in linea con quanto riportato negli studi randomizzati (PFS mediana di 6,9 mesi e OS mediana di 27,2 mesi) (Montemurro F, 2019). L’analisi delle 398 pazienti arruolate nel KAMILLA con metastasi cerebrali all’inizio del trattamento, ha evidenziato una risposta obiettiva del 21%, una stazionarietà del 21%, con PFS di 5,5 mesi e OS di 18,9 mesi (Montemurro F, 2020).
Il tucatinib (inibitore tirosin-chinasico di HER2) associato a trastuzumab+capecitabina e valutato vs placebo+ trastuzumab+capecitabina nello studio HER2Climb in 612 pazienti metastatiche pretrattate, ha riportato un vantaggio statisticamente significativo in PFS (7,8 mesi vs 5,6 mesi) e in OS (21,9 vs 17,4 mesi), con vantaggio anche nelle 291 pazienti con metastasi cerebrali (non sintomatiche/pretrattate): PFS a 1 anno del 24,9% nel gruppo tucatinib vs 0% nel gruppo placebo (HR=0,48; 95% CI, 0,34-0,69; p<0.001) e PFS mediana di 7,6 mesi vs 5,4 mesi (Murphy RK, 2020). In tutta la popolazione la OS mediana è stata di 24,7 mesi nel gruppo tucatinib vs 19,2 nel gruppo placebo (HR= 0,73; 95% CI 0,59-0,90; p=0,004), con HR a favore del tucatinb anche nel sottogruppo di pazienti con metastasi cerebrali al basale (HR=0,60; 95% CI 0,44-0,81) (Curigliano G, 2022).
In Italia, l’indicazione rimborsata da AIFA è relativa a tucatinib associato a trastuzumab e capecitabina nei pazienti con carcinoma HER2+ localmente avanzato o metastatico che abbiano ricevuto almeno due linee di trattamento anti-HER2. Nella scheda AIFA sono accettate le metastasi cerebrali stabili o attive, precedentemente trattate o non trattate, ma esiste un BLOCCO al rimborso di tucatinib nel caso di necessità di un dosaggio giornaliero >2mg di desametasone (o dose equivalente di altri corticosteroidi) per il controllo della sintomatologia neurologica.
Il Trastuzumab deruxtecan (antibody drug-conjugate) è stato valutato vs TDM-1 nello studio Destiny-Breast03, che ha arruolato 524 pazienti metastatiche HER2+ pretrattate, riportando un vantaggio significativo in PFS (HR=0,28; 95% CI 0,22-0,37; p<0,001) e anche un beneficio in PFS all’analisi di sottogruppo nelle 114 pazienti con metastasi cerebrali stabili/pretrattate al basale (HR=0,38; 95% CI 0,23-0,64) (Cortes J, 2022). Una pooled analysis delle 148 pazienti con metastasi cerebrali arruolate negli studi Destiny-Breast 01, 02 e 03, ha evidenziato una risposta intracranica del 45%, una PFS a livello cerebrale mediana di 12,3 mesi nelle pazienti con metastasi cerebrali pretrattate/stabili e di 18,5 mesi nelle pazienti con metastasi cerebrali attive/non pretrattate (Hurvitz SA,2023).
In Italia, l’indicazione rimborsata da AIFA di Trastuzumab deruxtecan nel carcinoma mammario HER2+ è relativa al suo utilizzo in monoterapia per il trattamento di pazienti adulti con cancro della mammella HER2-positivo non resecabile o metastatico, che hanno ricevuto uno o più precedenti regimi a base di anti-HER2 nel setting metastatico o hanno presentato una progressione di malattia durante un trattamento (neo)adiuvante o entro 6 mesi dalla sua interruzione. Nella scheda AIFA esiste un blocco all’utilizzo del farmaco nel caso di metastasi cerebrali ATTIVE.
In pazienti con malattia HER2+ e progressione encefalica asintomatica, candidabili a trattamento con Tucatinib, si potrebbe valutare anche di differire il trattamento locale alla luce dei risultati dello studio HER2Climb. E visti i risultati ottenuti con Trastuzumab deruxtecan, si potrebbe valutare tale approccio anche a pazienti candidati a T-DXd.
Nella malattia metastatica HR+/HER2-negativa, con metastasi cerebrali, l’endocrinoterapia è stata ampiamente usata (tamoxifene, fulvestrant, inibitori dell’aromatasi) in considerazione anche del favorevole profilo di tossicità. Abemaciclib ha dimostrato di ottenere livelli efficaci nel tessuto cerebrale metastatico, superiori a quelli di ribociclib e palbociclib (Tolaney SM, 2020). Uno studio clinico ha evidenziato che elacestrant può attraversare la barriera ematoencefalica (Conlan MG, 2020).
Nella malattia metastatica Triplo Negativa (TN) sono in corso studi clinici che stanno valutando in presenza di metastasi cerebrali capecitabina, i composti del platino, inibitori della topoisomerasi (etirinotecan pegol) e pembrolizumab. E’ importante effettuare studi clinici con inibitori di PARP (niraparib, olaparib, talazoparib) o altri farmaci che possono penetrare la barriera ematoencefalica per trattare le metastasi cerebrali di pazienti con carcinoma mammario TN e mutazioni germinali di BRCA, obiettivo importante anche per le pazienti TN senza mutazioni BRCA.
Malattia leptomeningea.
Le metastasi leptomenigee si associano a scarsa prognosi con OS mediana di 3-4 mesi dopo trattamento che può prendere in considerazione (in base alle caratteristiche biologiche della malattia, al PS della paziente, ai trattamenti già effettuati): RT, somministrazione intratecale di farmaci antitumorali oppure terapia sistemica antitumorale. Non è raccomandata la somministrazione intratecale di chemioterapici e RT a causa dell’alto tasso di neurotossicità (meningiti, encefolopatia, leucoencefalopatia). I dati finora disponibili derivano da studi retrospettivi e saranno importanti i dati che arriveranno dagli studi in corso.
Prevenzione delle metastasi cerebrali.
In questo ambito, il confronto tra apatinib + capecitabina vs trastuzumab+capecitabina in pazienti metastatiche HER2+ nello studio CEREBEL per valutare la prevenzione di comparsa di metastasi cerebrali come prima sede di progressione, non ha evidenziato differenze (Pivot X, 2015).
Il TDM-1 (trastuzumab-emtansine), nello studio KATHERINE di trattamento neoadiuvante vs trastuzumab nelle pazienti con residuo di malattia dopo neoadiuvante, non ha evidenziato un effetto preventivo sulla comparsa di metastasi cerebrali (prima sede di ripresa nel 5,9% delle pazienti trattate con TDM-1 vs 4,3% delle pazienti trattate con trastuzumab) (Mamounas EP, 2021).
Vari studi clinici sono in corso con tucatinib, sia nell’ambito della prevenzione delle metastasi cerebrali per pazienti HER2+ con residuo di malattia dopo neoadiuvante sia nelle pazienti metastatiche HER2+ che hanno avuto progressione isolata intracranica durante terapia con trastuzumab/pertuzumab o TDM-1, per prevenire l’ulteriore comparsa di metastasi cerebrali.
In conclusione, le metastasi cerebrali rappresentano ancora una problematica clinica rilevante e gli studi preclinici e clinici hanno evidenziato l’importanza della biologia del tumore e il ruolo del microambiente. L’utilizzo di tecniche radioterapiche che prevedono il risparmio dell’ippocampo possono ridurre le disfunzioni neurocognitive ma sono necessari ulteriori miglioramenti. Ulteriori opportunità potranno derivare da farmaci sistemici che superano la barriera emato-encefalica o che permettono la manipolazione del microambiente.
Bibliografia
Leone JP, Leone BA: Breast cancer brain metastases: The last frontier. Exp Hematol Oncol 2015; 124:142:155
Kennecke H, et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol 2010 Jul 10;28(20):3271-7JCO 2010; 28:3271-77.
Darlix A, Louvel G, Fraisse J, et al: Impact of breast cancer molecular subtypes on the incidence, kinetics and prognosis of central nervous system metastases in a large multicentre real-life cohort. Br J Cancer 121:991-1000, 2019
Shen Q, et al. Breast cancer with brain metastases: clinicopathologic features, survival, and paired biomarker analysis. Oncologist 2015 May;20(5):466-73
Witzel I, et al. Treatment and outcomes of patients in the Brain Metastases in Breast Cancer
Network Registry. Eur J Cancer. 2018 Oct;102:1-9.Dawood S, Oncologist 2013;18:675-84
Sperduto PW, et al. Summary report on the graded prognostic assessment: an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol. 2012 Feb 1;30(4):419-25.
Patchell RA, et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 1990 Feb 22;322(8):494-500.
Vecht CJ, et al. Treatment of single brain metastasis: radiotherapy alone or combined with neurosurgery? Ann Neurol. 1993 Jun;33(6):583-90
Vogelbaum MA, et al. Treatment for Brain Metastases: ASCO-SNO-ASTRO Guideline. J Clin Oncol. 2021; 40(5):492-516.
Yamamoto M, et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study. Lancet Oncol. 2014 Apr;15(4):387-95
Prabhu RS, et al. Single-Fraction Stereotactic Radiosurgery (SRS) Alone Versus Surgical Resection and SRS for Large Brain Metastases: A Multi-institutional Analysis. Int J Radiat Oncol Biol Phys. 2017 Oct 1;99(2):459-467.
Bachelot T, et al. Lapatinib plus capecitabine in patients with previously untreated brain metastases from HER2-positive metastatic breast cancer (LANDSCAPE): a single-group phase 2 study. Lancet Oncol. 2013 Jan;14(1):64-71
Montemurro F, et al. Safety of trastuzumab emtansine (T-DM1) in patients with HER2-positive advance breast cancer: Primary results from the KAMILLA study cohort 1. Eur J Cancer 2019; 10:, 92 – 102
Montemurro F, et al. Trastuzumab emtansine (T-DM1) in patients with HER2-positive metastatic breast cancer and brain metastases: exploratory final analysis of cohort 1 from KAMILLA, a single-arm phase IIIb clinical trial. Ann Oncol. 2020 Oct;31(10):1350-1358
Murthy RK, et al. Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):597-609.
Curigliano G, et al. Tucatinib versus placebo added to trastuzumab and capecitabine for patients with pretreated HER2+ metastatic breast cancer with and without brain metastases (HER2CLIMB): final overall survival analysis. Ann Oncol. 2022 Mar;33(3):321-329
Cortés J, et al; DESTINY-Breast03 Trial Investigators. Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med. 2022 Mar 24;386(12):1143-1154.
Hurvitz SA, et al. A pooled analysis of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) with brain metastases (BMs) from DESTINY-Breast (DB) -01, -02, and -03. Ann Oncol. 2023;34(suppl 2):S335-S336.
Tolaney SM, Sahebjam S, Le Rhun E, Bachelot T, Kabos P, Awada A, Yardley D, Chan A, Conte P, Diéras V, Lin NU, Bear M, Chapman SC, Yang Z, Chen Y, Anders CK. A Phase II Study of Abemaciclib in Patients with Brain Metastases Secondary to Hormone Receptor-Positive Breast Cancer. Clin Cancer Res. 2020 Oct 15;26(20):5310-5319
Conlan MG, de Vries EFJ, Glaudemans A, et al: Pharmacokinetic and pharmacodynamic studies of elacestrant, A novel oral selective estrogen receptor degrader, in healthy post-menopausal women. Eur J Drug Metab Pharmacokinet 45:675-689, 2020
Pivot X, et al. CEREBEL (EGF111438): A Phase III, Randomized, Open-Label Study of Lapatinib Plus Capecitabine Versus Trastuzumab Plus Capecitabine in Patients With Human Epidermal Growth Factor Receptor 2-Positive Metastatic Breast Cancer. J Clin Oncol. 2015 May 10;33(14):1564-73
Mamounas E.P. et al. Adjuvant T-DM1 versus trastuzumab in patients with residual invasive disease after neoadjuvant therapy for HER2-positive breast cancer: subgroup analyses from KATHERINE. Ann.Oncol 2021; 32 (8):1005-1014.


