
TRASTUZUMAB DERUXTECAN AFTER ENDOCRINE THERAPY IN METASTATIC BREAST CANCER.
Bardia A, Hu X, Dent R, Yonemori K, Barrios CH, O’Shaughnessy JA, Wildiers H, Pierga JY, Zhang Q, Saura C, Biganzoli L, Sohn J, Im SA, Lévy C, Jacot W, Begbie N, Ke J, Patel G, Curigliano G; DESTINY-Breast06 Trial Investigators.
N Engl J Med. 2024 Sep 15. doi: 10.1056/NEJMoa2407086
Link all’abstract: https://pubmed.ncbi.nlm.nih.gov/39282896/
Il carcinoma mammario HR+/HER2-negativo rappresenta il sottotipo più comune di cancro mammario (~70% di tutti i casi).
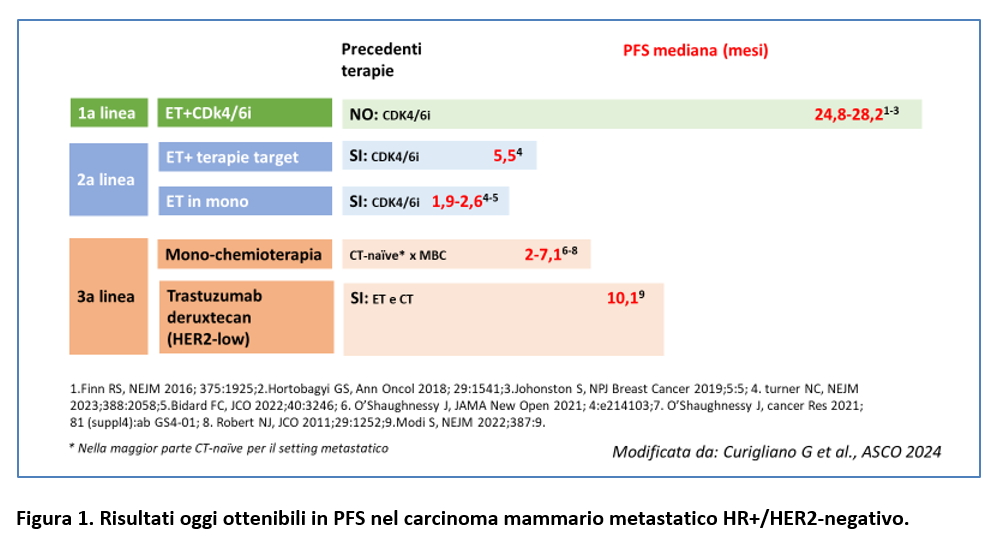
Ad oggi, il trattamento standard di 1a linea del ca mammario metastatico HR+/HER2-negativo è rappresentato da endocrinoterapia solitamente associata a inibitore di eDK4/6 ma rimane ancora poco chiara la più appropriata sequenza di terapie dopo la progressione (Figura 1).
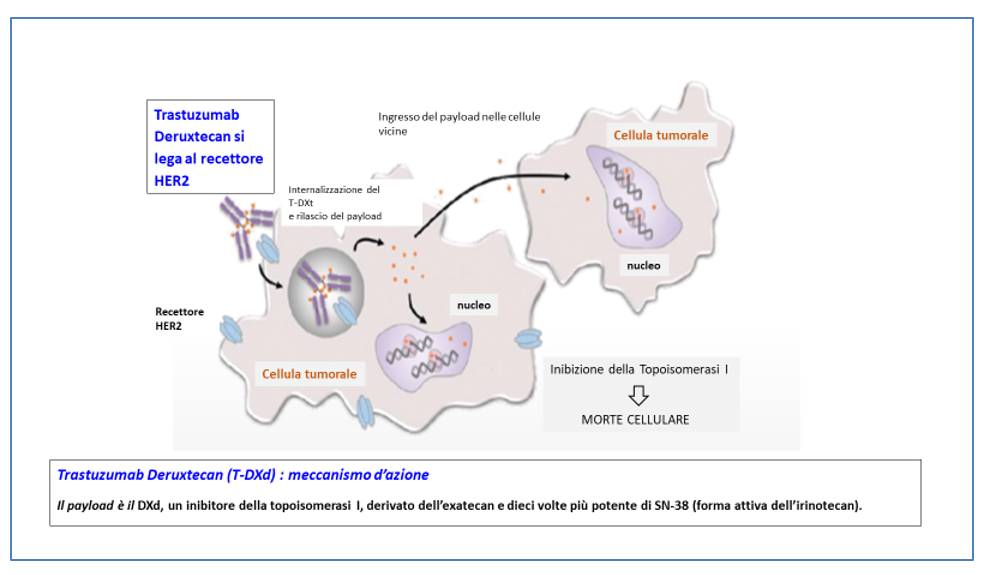
Il Trastuzumab deruxtecan è un anticorpo-farmaco coniugato, costituito da una immunoglobulina monoclonale anti-HER2 e un potente inibitore della topoisomerasi I.
Nello studio DESTINY-Breast04 è stato evidenziato un vantaggio statisticamente e clinicamente significativo in PFS del Trastuzumab deruxtecan rispetto alla chemioterapia standard in pazienti con carcinoma mammario metastatico HR+/HER2-LOW pretrattato (Modi S, NEJM 022). E, in base ai risultati dello studio clinico di fase 3 DESTINY-Breast 04, anche in Italia Trastuzumab deruxtecan è rimborsato dal Dicembre 2023 con la seguente indicazione: “In monoterapia per il trattamento di pazienti adulti con cancro della mammella HER2-low non resecabile o metastatico, che hanno ricevuto precedentemente chemioterapia per malattia metastatica o che hanno sviluppato recidive della malattia durante o entro sei mesi dal completamento della chemioterapia adiuvante (INNOVATIVITA’ PIENA) ( Gazzetta Ufficiale n.296 del 20-12-2023-Determina AIFA del 15 dicembre 2023 n.760/2023).
Lo studio di fase 3 DESTINY-Breast06 ha valutato l’efficacia e la safety di trastuzumab deruxtecan rispetto a chemioterapia scelta dall’investigatore in pazienti con carcinoma mammario metastatico HR+/HER2-LOW e HER2-ULTRALOW che avevano ricevuto una o due linee di endocrinoterapia ma non chemioterapia per la malattia metastatica.
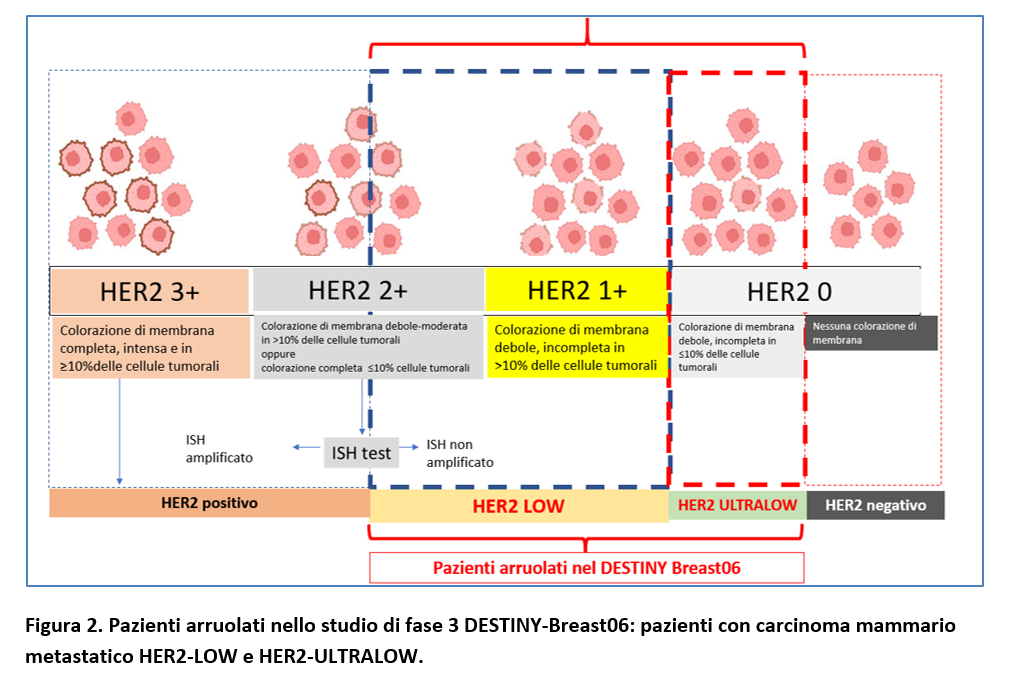
Esiste infatti uno spettro di espressione di HER2 tra i cancri mammari categorizzati come “HER2-negativi” definiti da uno score all’immunoistochimica (IHC) come 0, 1 e 2+ e ISH negativo (Figura 2).
I cancri con score all’IHC pari a 1+ o 2+ con ISH negativo sono oggi definiti come “HER2-LOW”. La categoria 0 all’IHC è suddivisa in due gruppi definiti in accordo alla colorazione della membrana cellulare tumorale:
- se debole e incompleta e presente nel 10% o meno di cellule tumorali si parla di cancro HER2-ULTRALOW;
- se assente, si parla di cancro HER2-negativo.
METODI
Lo studio DESTINY-Breast06 prevedeva di arruolare pazienti con carcinoma mammario HR+/HER2-LOW e ULTRALOW in progressione dopo almeno due linee di endocrinoterapia (ET) per la malattia metastatica.
Le pazienti erano eleggibili se avevano ricevuto una linea di ET per la malattia metastatica se avevano avuto recidiva di malattia entro 24 mesi dall’inizio di ET adiuvante oppure progressione di malattia entro 6 mesi dall’inizio di ET + CDK4/6i per la malattia metastatica.
I pazienti non erano eleggibili se avevano ricevuto chemioterapia per la malattia metastatica. La randomizzazione (1:1) prevedeva l’assegnazione a trastuzumab deruxtecan (5,4 mg/kg/IV-ogni 3 settimane) oppure chemioterapia scelta dall’investigatore (capecitabina, nab-paclitaxel o paclitaxel) fino a progressione o tossicità inaccettabile (Figura 3).
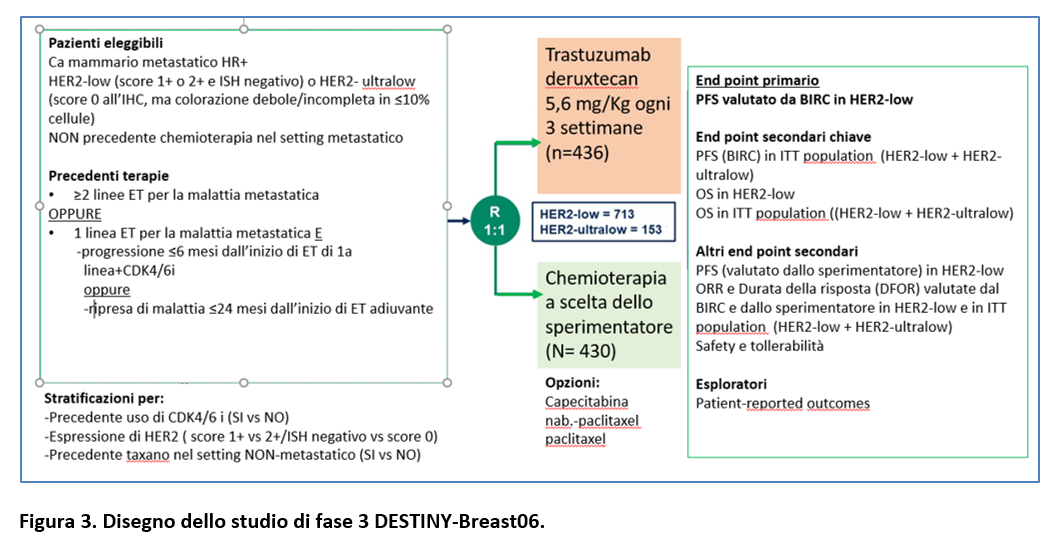
L’endpoint primario era la PFS nella popolazione HER2-LOW valutata centralmente e in cieco (Blinded Independent Central Review-BICR).
Endpoint secondari chiave erano:
- PFS nella ITT-population (HER2low + HER2ultralow) secondo BICR;
- OS nella popolazione HER2-LOW;
- OS nella ITT-population (Figura 3).
La safety è stata graduata secondo NCICTC-AE v.5.0.
RISULTATI
Da Agosto 2020 a Marzo 2024 sono state randomizzate 866 pazienti (da 324 centri oncologici): 436 sono state assegnate al gruppo trastuzumab deruxtecan e 430 al gruppo chemioterapia (59,8% hanno ricevuto capecitabina, 24,4% NAB-paclitaxel e 15,8% paclitaxel).
Un totale di 713 pazienti sono state incluse nella popolazione HER2-Low e 153 nella popolazione HER2-ULTRALOW.
Le caratteristiche basali erano ben bilanciate tra i due gruppi: età mediana 58 anni; stadio IV alla diagnosi oltre il 30%; numero mediano di linee di endocrinoterapia per la malattia metastatica 2; il 90,4% aveva ricevuto precedentemente un inibitore di CDK4/6 per la malattia metastatica.
Il 67,4% dei pazienti aveva ricevuto endocrinoterapia+CDK4/6i come prima linea e il 25,1% come seconda linea. Il 73,4% aveva ricevuto Fulvestrant da solo o in combinazione per la malattia metastatica.
Il follow-up mediano era di 18,2 mesi (range 0-42,9) per l’ITT population.
EFFICACIA
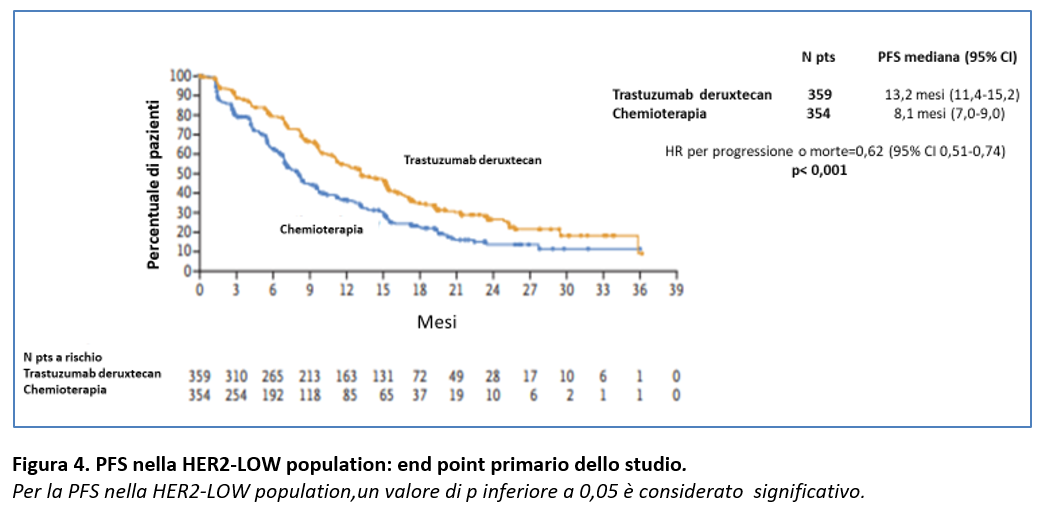
La PFS valutata dal BICR nella popolazione HER2-LOW (endpoint primario dello studio) è stata significamente più lunga con Trastuzumab deruxtecan rispetto a chemioterapia (HR=0,62; 95% CI: 0,51-0,74; p < 0,001) (Figura 4), al 18 marzo 2024 (data-cutoff).
La PFS mediana è stata di 13,2 mesi vs 8,1 mesi (Figura 4).
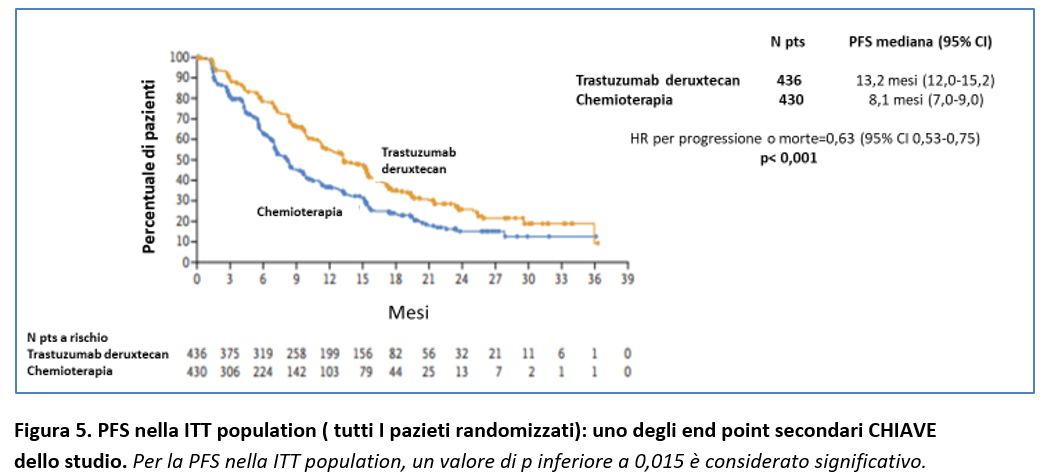
La PFS nella ITT-population (endpoint secondario) è risultata significativamente più lunga nel gruppo Trastuzumab deruxtecan rispetto al gruppo chemioterapia (PFS mediana 13,2 mesi vs 8,1 mesi; HR = 0,63; 95% CI, 0,53-0,75; p < 0,001) (Figura 5).
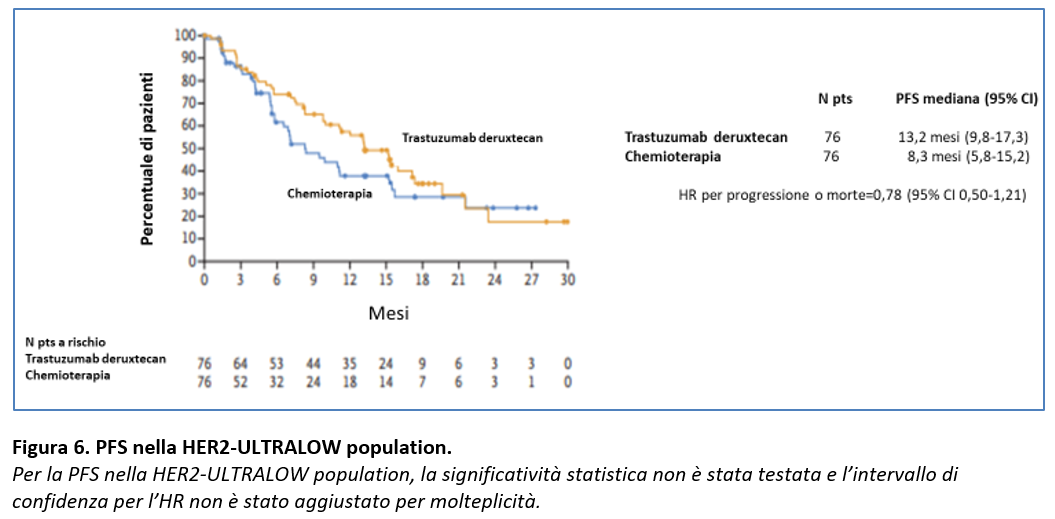
La PFS nella popolazione prespecificata esploratoria HER2-ULTRALOW è risultata simile nei due gruppi a quella riportata nella popolazione HER2-LOW (Figura 6).
Il Trastuzumab deruxtecan determina un vantaggio in PFS rispetto alla chemioterepia in tutti i sottogruppo specificati.
I dati per la OS sono ancora immaturi. Nella popolazione HER2-LOW, sono deceduti 37,9% dei pazienti del gruppo Trastuzumab deruxtecan e il 41,2% del gruppo chemioterapia.
RISPOSTA AL TRATTAMENTO
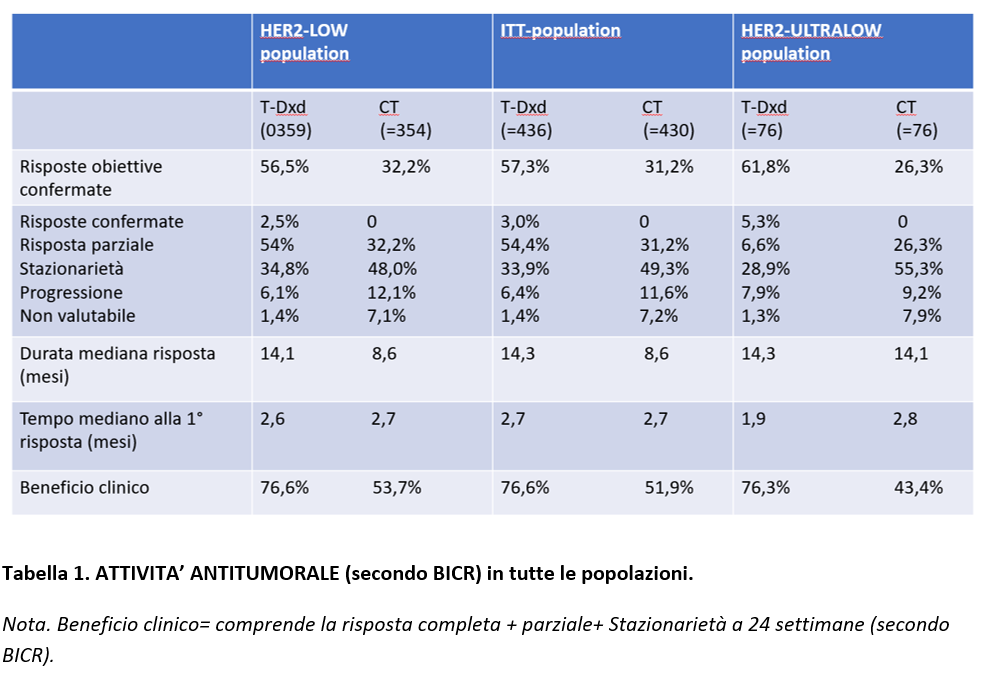
La risposta al trattamento (in accordo con la valutazione indipendente centralizzata in cieco) in tutte le popolazioni è riportata nella Tabella 1. Nella popolazione HER2-LOW è stato riportato un tasso di risposte obiettive confermate del 56,5% con Trastuzumab deruxtecan vs 23,2% con chemioterapia, con una durata mediana di 14,1 mesi vs 8,6 mesi. Risultati analoghi sono stati riportati nella ITT-population.
SAFETY
La safety è stata valutata in 851 pazienti. Eventi avversi di grado uguale o superiore a 3, si sono verificati nel 52,8% dei pazienti del gruppo T-Dxd e nel 44,4% del gruppo chemioterapia. In particolare, è stata riportata una malattia polmonare interstiziale/polmonite in 49/434 pazienti (11,3%) del gruppo Trastuzumab deruxtecan (T-Dxd) in 1/417 (0,2%) del gruppo chemioterapia. Tra i 49 pazienti del gruppo T-Dxd è stata osservata una tossicità a livello polmonare di grado 3 in 3 pazienti (0,7%), di grado 4 in nessun paziente e di grado 5 (decesso) in 3 pazienti (0,7%); l’unico paziente con tale tossicità del gruppo chemioterapia ha avuto un grado 2.
Relativamente alla riduzione della Frazione di Eiezione del Vsx (FEVsx), è stata riportata di qualsiasi grado nell’8,1% (35/434) pazienti del gruppo T-Dxd (grado 1 in 1 paziente; grado 2 in 31 pazienti e grado 3 in 3 pazienti) rispetto al 2,9% (12/417) pazienti del gruppo chemioterapia (11 pazienti di grado 2 e un paziente con grado 3).
CONCLUSIONI
Il Trastuzumab deruxtecan ha evidenziato un beneficio statisticamente e clinicamente rilevante in PFS, rispetto a chemioterapia, in pazienti con carcinoma mammario metastatico HR+/HER2-LOW che avevano ricevuto una o più linee di endocrinoterapia per la malattia metastatica ma non chemioterapia.
I risultati nella popolazione HER2-ULTRALOW sono stati in linea con quelli ottenuti nella popolazione HER2-LOW.
Non sono state segnalate nuove tossicità del T-Dxd.
BIBLIOGRAFIA
Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, Tsurutani J, Ueno NT, Prat A, Chae YS, Lee KS, Niikura N, Park YH, Xu B, Wang X, Gil-Gil M, Li W, Pierga JY, Im SA, Moore HCF, Rugo HS, Yerushalmi R, Zagouri F, Gombos A, Kim SB, Liu Q, Luo T, Saura C, Schmid P, Sun T, Gambhire D, Yung L, Wang Y, Singh J, Vitazka P, Meinhardt G, Harbeck N, Cameron DA; DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. doi: 10.1056/NEJMoa2203690.
Wolff AC, Somerfield MR, Dowsett M, Hammond MEH, Hayes DF, McShane LM, Saphner TJ, Spears PA, Allison KH. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: ASCO-College of American Pathologists Guideline Update. J Clin Oncol. 2023 Aug 1;41(22):3867-3872. doi: 10.1200/JCO.22.02864
Tarantino P, Viale G, Press MF, Hu X, Penault-Llorca F, Bardia A, Batistatou A, Burstein HJ, Carey LA, Cortes J, Denkert C, Diéras V, Jacot W, Koutras AK, Lebeau A, Loibl S, Modi S, Mosele MF, Provenzano E, Pruneri G, Reis-Filho JS, Rojo F, Salgado R, Schmid P, Schnitt SJ, Tolaney SM, Trapani D, Vincent-Salomon A, Wolff AC, Pentheroudakis G, André F, Curigliano G. ESMO expert consensus statements (ECS) on the definition, diagnosis, and management of HER2-low breast cancer. Ann Oncol. 2023 Aug;34(8):645-659. doi: 10.1016/j.annonc.2023.05.008


