
NEOADJUVANT NIVOLUMAB AND IPILIMUMAB IN RESECTABLE STAGE III MELANOMA.
Blank CU, Lucas MW, Scolyer RA, van de Wiel BA, Menzies AM, Lopez-Yurda M, Hoeijmakers LL, et al.
N Engl J Med. 2024 Jun 2. doi: 10.1056/NEJMoa2402604.
Il NADINA Trial è stato presentato all’ASCO 2024 e pubblicato contemporaneamente nel New England Journal Medicine a giugno 2024.
Ad oggi lo standard terapeutico del melanoma resecabile, stadio III macroscopico, è rappresentato da CHIRURGIA (ampia escissione+ dissezione linfonodale completa) seguita da terapia sistematica adiuvante. Gli inibitori di PD-1 (nivolumab o pembrolizumab) hanno dimostrato nel setting adiuvante di prolungare la Recurrence-Free Survival rispetto ad ipilimumab o rispetto a placebo (Ascierto PA, 2020; Eggermant AMM, 2022), mentre la terapia adiuvante anti-BRAF con dabrafenib e trametinib ha dimostrato un vantaggio in Recurrence-Free Survival rispetto a placebo (54% vs 38% a 4 anni) (Hauschild A, 2018) nei pazienti con mutazione BRAF V600E o BRAF V600K.
Tuttavia, nonostante il trattamento adiuvante sistemico, una proporzione sostanziale di pazienti ha una ripresa di malattia nei primi 5 anni dopo la chirurgia. Inoltre, nessuna immunoterapia adiuvante approvata ha dimostrato un vantaggio significativo in sopravvivenza globale (Eggermant AA 2022; Larkin J 2023), evidenziando la necessità di nuovi approcci terapeutici.
Sulla base dei dati preclinici e di fase 1 relativi alla somministrazione neoadiuvante di inibitori del check-point immunitario, e sulla base dei risultati in Event-Free Survival (EFS) di studi di fase 2 (OPACIN trial e PRADO trial) che hanno valutato pembrolizumab in neoadiuvante oppure ipilimumab + nivolumab, è stato disegnato lo studio randomizzato di fase 3 NADINA (Neoadjuvant Ipilinumab plus Nivolumab versus Standard Adjuvant Nivolumab in macroscopic, resectable, stage III Melanoma), che ha confrontato lo standard terapeutico rispetto all’immunoterapia neoa-diuvante in pazienti con melanoma resecabile, stadio III macroscopico.
METODI
In questo studio di fase 3 sono stati arruolati pazienti (di almeno 16 anni di età) con melanoma (cutaneo o acrale o a sede primitiva sconosciuta) resecabile, stadio III macroscopico, con almeno una metastasi linfonodale patologicamente dimostrata e un massimo di 3 metastasi in transit. Erano elegibili anche pazienti con melanoma primario concomitante.
La malattia macroscopica veniva definita come metastasi linfonodale comprovata patologicamente che era palpabile, positiva alla PET o misurabile secondo criteri RECIST v.1.1.
I pazienti sono stati randomizzati (1:1) a ricevere immunoterapia neo-adiuvante seguita da chirurgia linfonodale (gruppo A) oppure chirurgia linfonodale seguita da immunoterapia adiuvante (Gruppo B). (Figura 1).
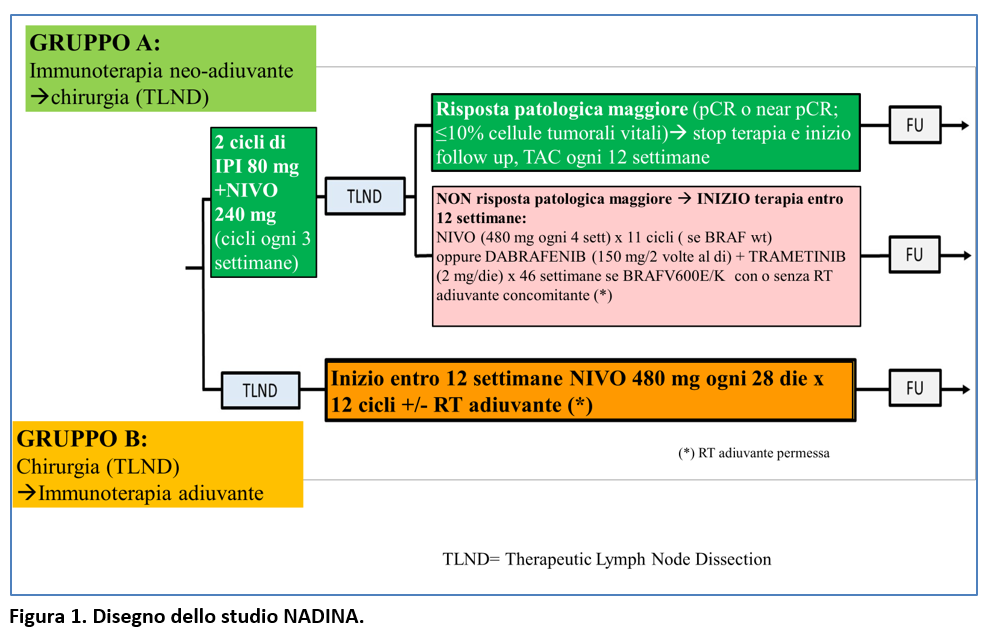
Nel braccio A, l’immunoterapia neo-adiuvante era seguita da chirurgia (dissezione linfonodale terapeutica e, se presente, resezione della metastasi in transit) e poi da follow up (se risposta patologica maggiore) oppure da terapia adiuvante (se non risposta patologica maggiore) (Figura 1). La risposta patologica maggiore (Major Pathological Response=MPR) è stata definita come risposta completa patologica (pCR: assenza di cellule tumorali vitali) oppure come risposta patologica quasi completa (1-10% di cellule tumorali vitali).
Nel braccio B, i pazienti venivano sottoposti a chirurgia e poi a immunoterapia adiuvante con Nivolumab per 12 cicli (iniziando tra 6 e 12 settimane dalla chirurgia) (Figura 1).
La Radioterapia era permessa in entrambi i gruppi, ad eccezione dei pazienti con Risposta Patologica Maggiore dopo Immunoterapia neo-adiuvante.
I fattori di stratificazione includevano:
- continente;
- presenza di mutazione BRAF V600E o V600K;
- presenza di metastasi in transit.
L’endpoint primario era l’Event-Free Survival (EFS), definita come l’intervallo di tempo dalla randomizzazione alla comparsa di progressione (per melanoma non resecabile prima della chirurgia), oppure ripresa di melanoma o morte (per melanoma o per tossicità del trattamento). L’EFS è stato valutata in tutti i pazienti randomizzati (intention-to-treat population=ITT).
I pazienti che non hanno avuto un evento al momento della prima analisi ad interim (data cut off: 12 gennaio 2024) sono stati “censored” alla data dell’ultimo dato di imaging riportato.
L’endopoint secondario chiave era la sopravvivenza globale (i dati della OS rimarranno blinded fino all’analisi finale pre-specificata, a 3 anni dopo l’arruolamento dell’ultimo paziente nello studio). Altri endpoint secondari includevano:
- Recurrence-Free Survival;
- Distant metastasis-Free Survival;
- Risposta Patologica (pathological response);
- Safety;
- Quality of Life;
- Surgical complications.
La valutazione della risposta patologica è stata condotta in accordo ai criteri dell’International Neoadjuvant Melanoma Consortium e una revisione centralizzata retrospettiva è stata fatta al Netherlands Cancer Institute e al Melanoma Institute Australia.
RISULTATI
Da luglio 2021 a Dicembre 2023 sono stati randomizzati 423 pazienti: 212 sono stati assegnati al gruppo neoadiuvante (Gruppo A) e 211 al gruppo adiuvante (Gruppo B).
Le caratteristiche dei pazienti erano ben bilanciate tra i due gruppi e la popolazione dello studio fu considerata rappresentativa della popolazione globale con melanoma stadio III (oltre il 60% dei pazienti arruolati erano uomini; l’età mediana era di circa 60 anni; il PS sec.WHO era zero in oltre il 90% dei pazienti; la lesione era ulcerata nel 30% circa dei casi; metastasi in-transit erano presenti nel 10% circa dei casi).
Dati di Efficacia (ITT Population)
Al momento della data del cut-off (12 gennaio 2024), la durata mediana del follow up era di 10,6 mesi nel gruppo neo-adiuvante e di 9,9 mesi nel gruppo adiuvante.
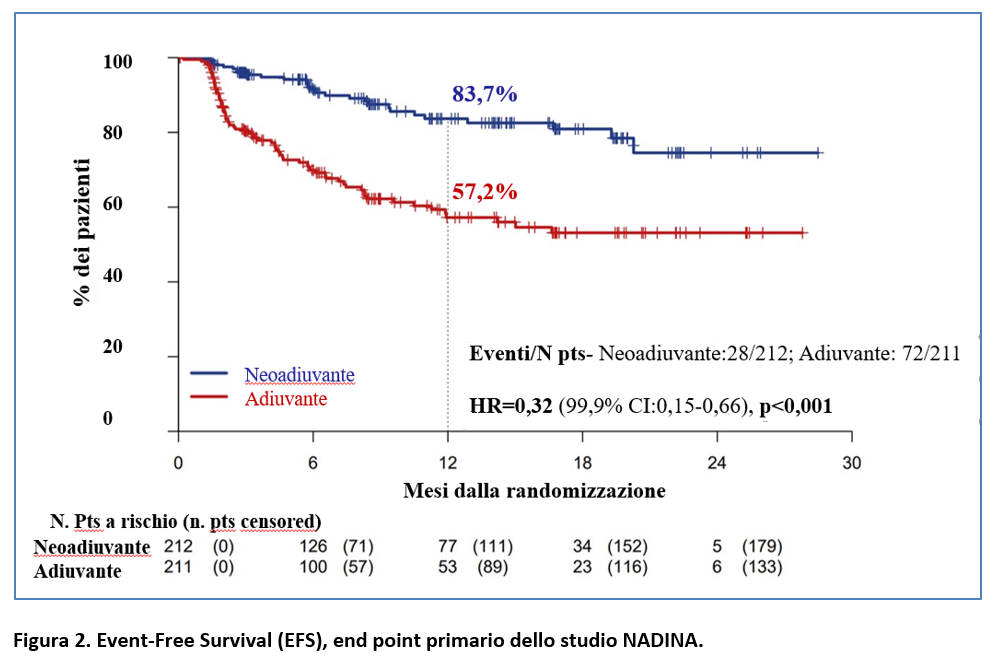
Si erano verificati 100 eventi (progressione, ripresa o morte da melanoma o da trattamento) nell’ITT population, di cui 28 nel gruppo neo-adiuvante e 72 nel gruppo adiuvante.
L’Event-Free Survival è risultata significativamente più lunga nel gruppo neo-adiuvante rispetto al gruppo adiuvante. L’EFS a 12 mesi è stata dell’83,7% (99,9% CI, 73,8-94,8) versus 57,2% (99,9% CI, 45,1-72,7) (Figura 2), con un HR=0,32 (99,9% CI : 0,15-0,66); p< 0,001.
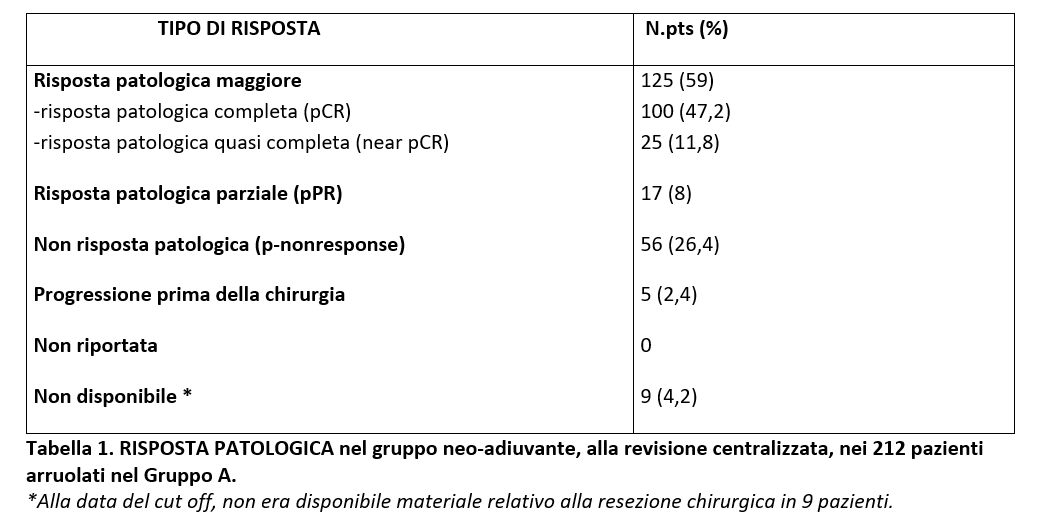
Risposta nel gruppo neo-adiuvante
Tutti i 212 pazienti hanno ricevuto almeno una dose di immunoterapia neo-adiuvante e quindi erano valutabili per la risposta patologica. Nella Tabella 1 sono riportate le risposte patologiche valutate alla revisione centralizzata.
Efficacia in base allo stato mutazionale di BRAF
L’EFS a 12 mesi è stata più lunga nel gruppo neo-adiuvante rispetto al gruppo adiuvante sia nei pazienti con mutazione V600E o V600K di BRAF (Figura 3) che nei pazienti BRAF wild-type (Figura 4).
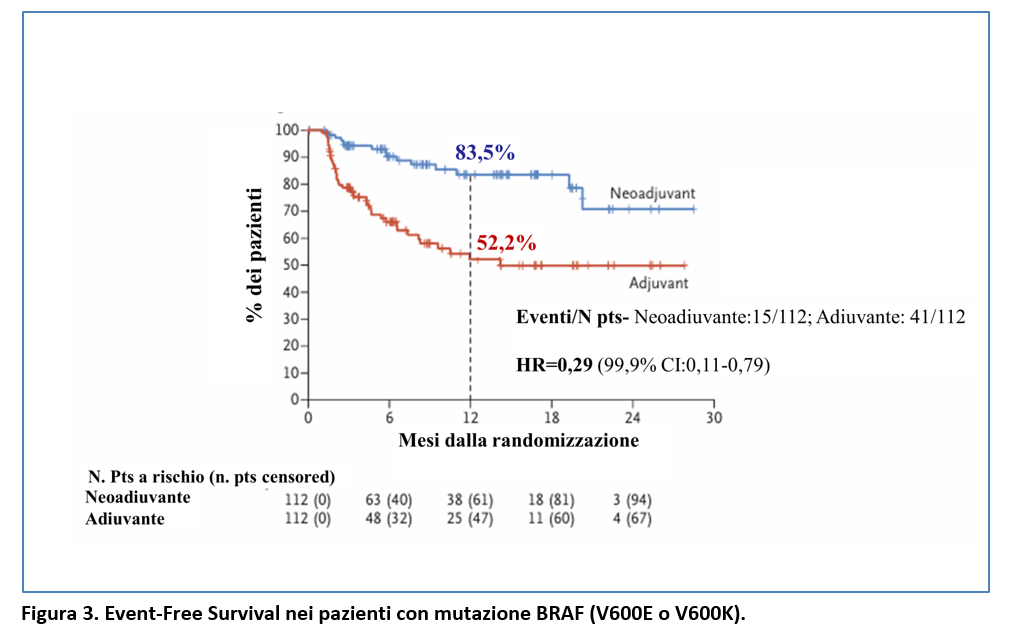
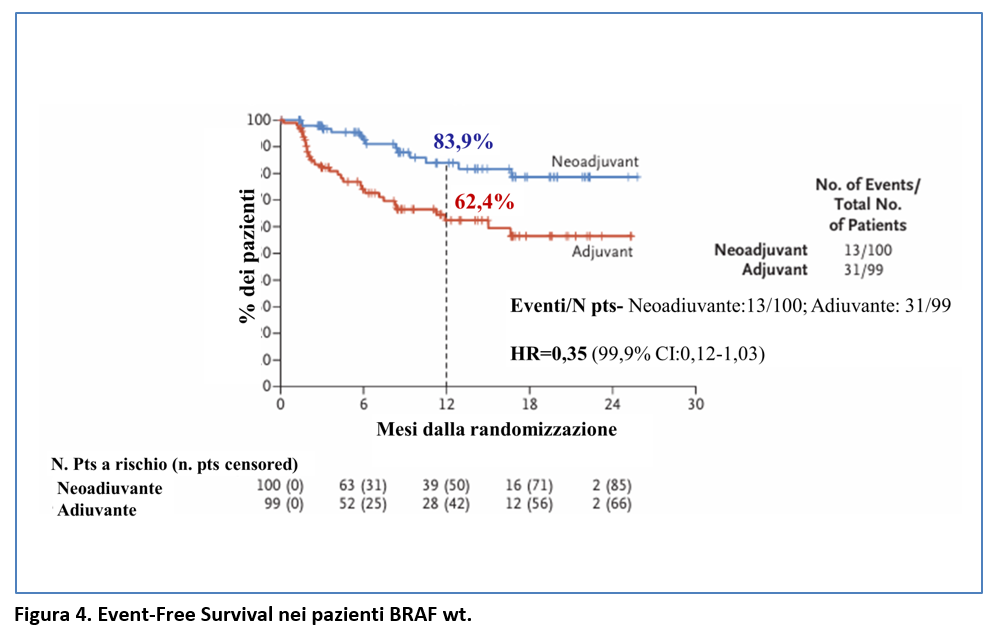
Tra i pazienti del gruppo neo-adiuvante, il 53,8% di quelli con melanoma BRAF-mutato e il 65,3% di quelli con melanoma BRAF-WT hanno avuto una risposta patologica maggiore.
Efficacia in base alla risposta patologica
Tra i 212 pazienti del gruppo neoadiuvante, 198 (93,4%) hanno avuto una risposta patologica maggiore, una pRP o una non risposta patologica e potrebbero essere valutati per la Recurrence-Free Survival in base alla risposta ottenuta.
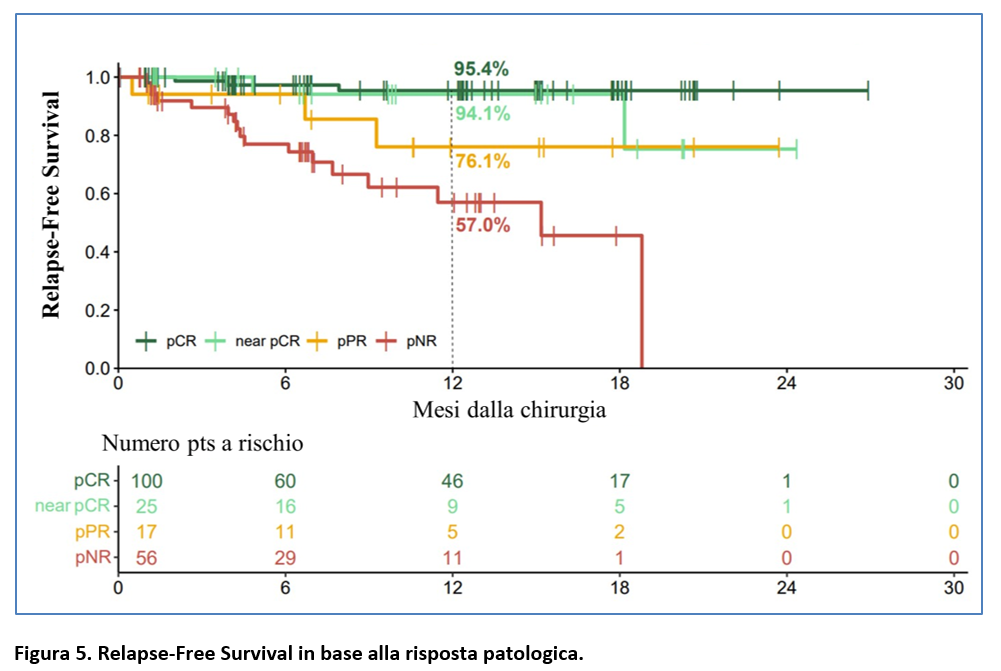
La RFS a 12 mesi è stata pari al 95,1% tra i pazienti con risposta patologica maggiore, 76,1% in quelli con risposta patologica parziale e 57% in quelli con non-risposta patologica (Figura 5). La RFS a 12 mesi nei pazienti con pCR è stata del 95,4% e in quelli con near-pCR è stata del 94,1% (Figura 5).
Questi risultati confermerebbero che la risposta patologica si correla con la RFS, sebbene sia necessario un follow up prolungato per trarre conclusioni definitive.
Inoltre, la RFS a 12 mesi è stata pari a solo il 76,1% tra i pazienti con risposta patologica parziale, nei quali è stata somministrata anche terapia adiuvante.
Studi precedenti hanno riportato RFS simili (73% nel trial PRADO) o migliori (100% nel trial OpACIN-neo) a 12 mesi senza trattamento adiuvante.
Questi risultati indicano che il sottogruppo di pazienti che ha ottenuto una pPR potrebbe essere troppo e troppo eterogeneo nei vari trials e che il ruolo della terapia adiuvante in questo sottogruppo rimane ancora poco compreso.
SAFETY
Eventi avversi di grado uguale o superiore a 3 correlati al trattamento sistemico sono stati riportati nel 29,7% dei pazienti del gruppo neo-adiuvante e nel 14,7% del gruppo adiuvante.
Le endocrinopatie da immunoterapia più frequentemente riportate sono state l’ipotiroidismo e l’insufficienza surrenalica. Non sono stati osservati nuovi eventi avversi correlati a nivolumab con o senza ipilimumab oppure correlati a dabrafenib e trametinib.
Nel gruppo adiuvante si è avuto un decesso per polmonite da nivolumab. Nessun decesso è stato riportato nel gruppo neoadiuvante.
CONCLUSIONI
Tra i pazienti con melanoma resecabile, stadio III macroscopico, una terapia neo-adiuvante con ipilimumab e nivolumab seguita da chirurgia e da terapia adiuvante (in base alla risposta patologica) determina una più lunga Sopravvivenza libera da Eventi (EFS) a 12 mesi rispetto alla terapia adiuvante con nivolumab somministrata dopo chirurgia. Questi risultati sono in linea con quelli riportati dalla studio OpACIN e dallo studio PRADO, ma è necessario un più lungo follow up per valutare l’EFS a lungo termine, la sopravvivenza libera da metastasi, la Quality of Life e la sopravvivenza globale.
Bibliografia
Ascierto PA, Del Vecchio M, Mandalá M, et al. Adjuvant nivolumab versus ipi limumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 2020;21:1465-77.
Eggermont AMM, Kicinski M, Blank CU, et al. Five-year analysis of adjuvant pem brolizumab or placebo in stage III melanoma. NEJM Evid 2022; 1(11): EVIDoa2200214.
Hauschild A, Dummer R, Schadendorf D, et al. Longer follow-up confirms relapse-free survival benefit with adjuvant dabrafenib plus trametinib in patients with resected BRAF V600-mutant stage III melanoma. J Clin Oncol 2018; 36: 3441-9.
Larkin J, Del Vecchio M, Mandalá M, et al. Adjuvant nivolumab versus ipilim umab in resected stage III/IV melanoma: 5-year efficacy and biomarker results from CheckMate 238. Clin Cancer Res 2023;29:3352-61.
COMMENTO
I risultati dello studio NADINA sono stati presentati all’ASCO 2024 e sono stati contemporaneamente pubblicati nel NEJM a giugno 2024.
Per ulteriori approfondimenti, collegarsi al video del POST-CHICAGO 2024 di AIGOM ( 17 giugno 2024) ed ascoltare la relazione della Prof.ssa Paola Queirolo:
https://www.aigom.it/2024/06/18/le-novita-da-chicago-2024-17-giugno-2024-ore-15-00-18-00/
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/38828984/


