
ADJUVANT TRASTUZUMAB EMTANSINE VERSUS PACLITAXEL PLUS TRASTUZUMAB FOR STAGE I HUMAN EPIDERMAL GROWTH FACTOR RECEPTOR 2-POSITIVE BREAST CANCER: 5-YEAR RESULTS AND CORRELATIVE ANALYSES FROM ATEMPT.
Tarantino P, Tayob N, Villacampa G, Dang C, Yardley DA, Isakoff SJ, Valero V, Faggen M, Mulvey T, Bose R, Weckstein D, Wolff AC, Reeder-Hayes K, Rugo HS, Ramaswamy B, Zuckerman D, Hart L, Gadi VK, Constantine M, Cheng K, Garrett AM, Marcom PK, Albain K, DeFusco P, Tung N, Ardman B, Nanda R, Jankowitz RC, Rimawi M, Abramson V, Pohlmann PR, Van Poznak C, Forero-Torres A, Liu MC, Ruddy KJ, Waks AG, DeMeo M, Burstein HJ, Partridge AH, Dell’Orto P, Russo L, Krause E, Newhouse DJ, Kurt BB, Mittendorf EA, Schneider B, Prat A, Winer EP, Krop IE, Tolaney SM; Consortium of the TBCRC Translational Investigators; TBCRC Translational Investigators.
J Clin Oncol. 2024 Jun 27:JCO2302170. doi: 10.1200/JCO.23.02170. Epub ahead of print. PMID: 38935923. OPEN ACCESS
Nello studio ATEMPT di fase II (Tolaney SM, 2021), le pazienti con carcinoma mammario HER2-positivo stadio I erano state randomizzate (3:1) a ricevere T-DM1 adiuvante per 1 anno (3,6 mg/Kg/iv ogni 3 settimane x 17 cicli) oppure paclitaxel+trastuzumab (TH). Con lo schema TH i pazienti ricevevano 12 dosi settimanali di paclitaxel 80 mg/mq/iv/settimana e trastuzumab settimanale (dose carico di 4 mg/Kg seguito da 2 mg/Kg/iv/settimana). Dopo il completamento di 12 dosi settimanali di TH, i pazienti ricevevano trastuzumab trisettimanale (6mg/Kg/iv ogni 3 settimane) x 13 dosi (TH) (Figura1).
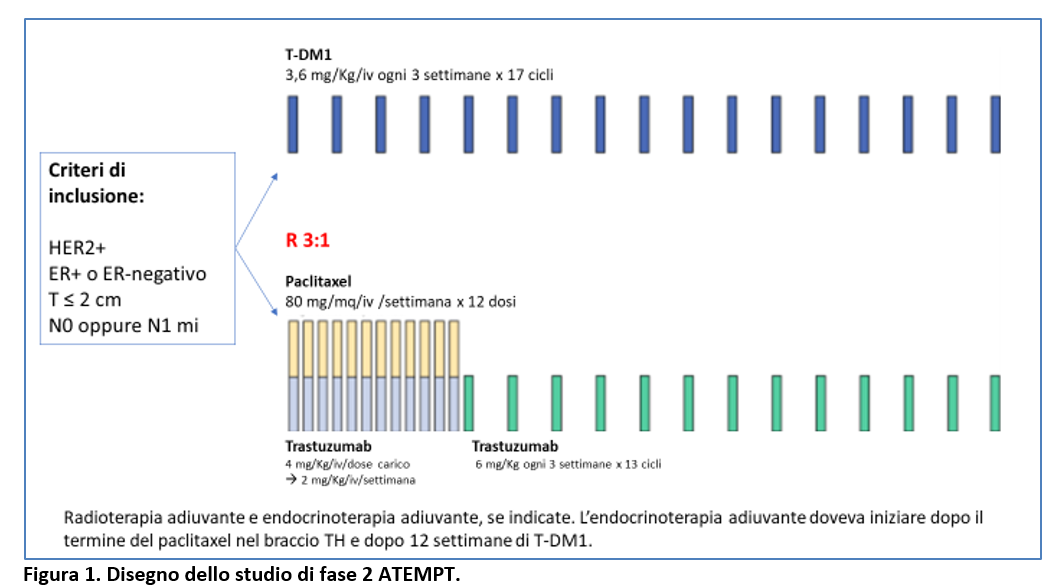
Da maggio 2013 a dicembre 2016 sono stati randomizzati 512 pazienti: 383 hanno ricevuto T-DM1 e 128 TH.
I due endpoint co-primari dello studio ATEMPT erano:
–l’invasive-DFS (iDFS) nei pazienti che avevano ricevuto TDM1 (l’iDFS veniva definita come il tempo intercorso tra la randomizzazione e la comparsa di recidiva invasiva locale/regionale omolaterale oppure di carcinoma invasivo controlaterale oppure di metastasi a distanza o morte per qualsiasi causa);
–il confronto nell’incidenza di eventi avversi nei pazienti trattati con T-DM1 vs TH.
Ad un follow up mediano di 3,9 anni, l’iDFS per il T-DM1 è stata di 97,8% (95% CI 96,3-99,3), con un tasso di ripresa a 3 anni del 2,2%, inferiore al 5% ritenuto secondo l’ipotesi statistica iniziale il valore soglia per considerare lo studio positivo.
L’incidenza di eventi avversi è stata sovrapponibile tra i pazienti trattati con T-DM1 (46%) e TH (47%), ma gli eventi avversi erano differenti tra i due gruppi e gli eventi avversi di grado ≥ 2 erano significativamente superiori nei pazienti trattati con TH (per esempio: neuropatia 23% vs 11% nel gruppo T-DM1; alopecia: 41% vs 0).
In questa analisi finale pre-specificata (Tarantino P, JCO 2024), vengono riportati:
— i risultati di sopravvivenza a 5 anni dei pazienti trattati con T-DM1;
— i risultati delle analisi di vari bio-markers valutati per identificare pazienti a maggior rischio di ripresa nonostante il trattamento adiuvante.
RISULTATI
Dopo un follow-up mediano di 5,8 anni, nel braccio T-DM1 sono stati osservati 11 eventi di iDFS, coerenti con una iDFS a 5 anni del 97,0% (95% CI, 95,2 – 98,7).
Il Recurrence-Free Interval (RFI) è stato del 98,3% (95% CI, 97-99,7);
la sopravvivenza globale è stata del 97,8% (95% CI, 96,3-99,3);
la sopravvivenza carcinoma mammario-specifica è stata del 99,4% (95% CI, 98,6-100).
Con T-DM1 è stata osservata una iDFS sovrapponibile, indipendentemente dalle dimensioni del tumore, dallo stato del recettore ormonale, dal punteggio immunoistochimico HER2 determinato a livello centrale e dalla somministrazione di T-DM1 per più o meno di 6 mesi.
Sebbene l’ATEMPT non fosse potenziato per questo end point, l’iDFS a 5 anni nel braccio TH è stata pari al 91,1%.
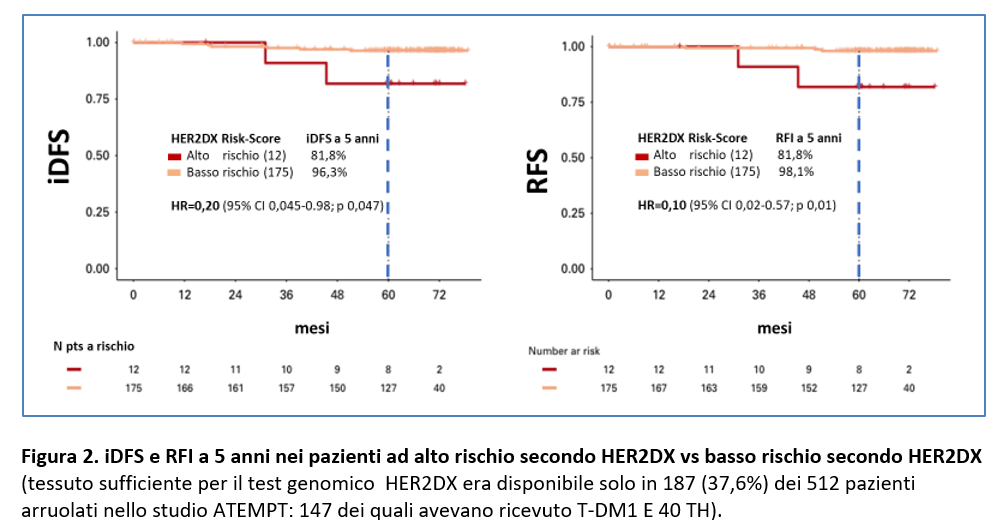
Tessuto sufficiente per il test genomico HER2DX era disponibile solo in 187 (37,6%) dei 512 pazienti arruolati nello studio ATEMPT, 147 dei quali avevano ricevuto T-DM1 E 40 TH.
In questi 187 pazienti sono stati evidenziati 12 pazienti ad alto rischio di ripresa secondo HER2DX (pari al 6,4%) e 175 a basso rischio (pari al 93,6%).
Rispetto ai pazienti ad alto rischio secondo HER2DX, i pazienti a basso rischio (sempre secondo HER2DX) hanno avuto una significativa migliore RFI a 5 anni (98,1% v 81,8%, HR= 0,10; p = 0,01) e iDFS a 5 anni (96,3% v 81,8%, HR= 0,20; p =0,047) (Figura 2).
CONCLUSIONI
- La somministrazione di T-DM1 adiuvante per 1 anno determina risultati importanti a lungo termine per le pazienti con cancro mammario HER2-positivo in stadio I, con solo tre riprese di malattia a distanza dopo oltre 5 anni di follow up mediano. Buona è risultata la tollerabilità al trattamento adiuvante (minor tasso di neuropatia ≥ grado 2 e nessun caso di alopecia ≥grado2 rispetto alla terapia con TH).
- Nell’ambito della popolazione con cancro mammario HER2-positivo stadio I dello studio ATEMPT, un punteggio di rischio HER2DX elevato predice un rischio maggiore di recidiva nono stante la terapia adiuvante (il test HER2DX è stato tuttavia eseguito su tessuto tumorale disponibile soltanto in 187 dei 512 pazienti arruolati).
- Nei pazienti con cancro mammario HER2-positivo stadio I sono in corso inoltre alcuni studi per migliorare ulteriormente la tollerabilità della terapia adiuvante.
Lo studio di fase 2 ATEMPT 2.0 sta testando 6 cicli di T-DM1 adiuvante nei tumori HER2-positivi
stadio I e lo studio di fase 2 ADEPT sta testando una endocrinoterapia adiuvante (senza
chemioterapia) in combinazione con trastuzumab e pertuzumab sottocute nei pazienti con tumori
HR+/HER2-positivi in stadio I.
BIBLIOGRAFIA
Tolaney SM, Tayob N, Dang C, et al: Adjuvant trastuzumab emtansine versus paclitaxel in combination with trastuzumab for stage I HER2-positive breast cancer (ATEMPT): A randomized clinical trial. J Clin Oncol 39:2375-2385, 2021. FREE ACCESS
Link all’abstract:
https://pubmed.ncbi.nlm.nih.gov/38935923/


