
CAPItello-291 STUDY GROUP. CAPIVASERTIB IN HORMONE RECEPTOR-POSITIVE ADVANCED BREAST CANCER.
Turner NC, Oliveira M, Howell SJ, Dalenc F, Cortes J, Gomez Moreno HL, Hu X, Jhaveri K, Krivorotko P, Loibl S, Morales Murillo S, Okera M, Park YH, Sohn J, Toi M, Tokunaga E, Yousef S, Zhukova L, de Bruin EC, Grinsted L, Schiavon G, Foxley A, Rugo HS; CAPItello-291 Study Group.
N Engl J Med. 2023 Jun 1;388(22):2058-2070. doi: 10.1056/NEJMoa2214131.
Capivasertib in combinazione con fulvestrant è stato approvato da EMA a fine giugno 2024 per il trattamento di pazienti adulti con cancro mammario localmente avanzato o metastatico ER-positivo e HER2-negativo, con una o più alterazioni di PIK3CA, AKT1, o PTEN, dopo recidiva o progressione durante o dopo un regime a base endocrina.
L’approvazione di EMA fa seguito al parere positivo del Committee for Medicinal Products for Human Use e si basa sui risultati dello studio di fase III CAPItello-291 pubblicati sul New England Journal of Medicine 2023.
Studio CAPItello-291
Circa il 70% dei cancri mammari avanzati sono recettori ormonali positivi (HR+) e HER2-negativi. In questi
pazienti la terapia endocrina (spesso un antiaromatasico) combinata con un inibitore di CDK4/6 rappresenta la terapia di prima linea, determinando un aumento statisticamente e clinicamente significativo della PFS rispetto ad una monoterapia con antiaromatasico. D’altra parte, la maggior parte di queste pazienti presenta una progressione di malattia e il fulvestrant può rappresentare una opzione di terapia di seconda linea. AKT è un nodo chiave della via del segnale PI3K-AKT-PTEN (Figura 1) e l’ iperattivazione di questa via si verifica in circa la metà dei tumori HR+/HER2- a seguito di mutazione attivanti di PIK3CA e AKT1 e alterazioni inattivanti di PTEN.
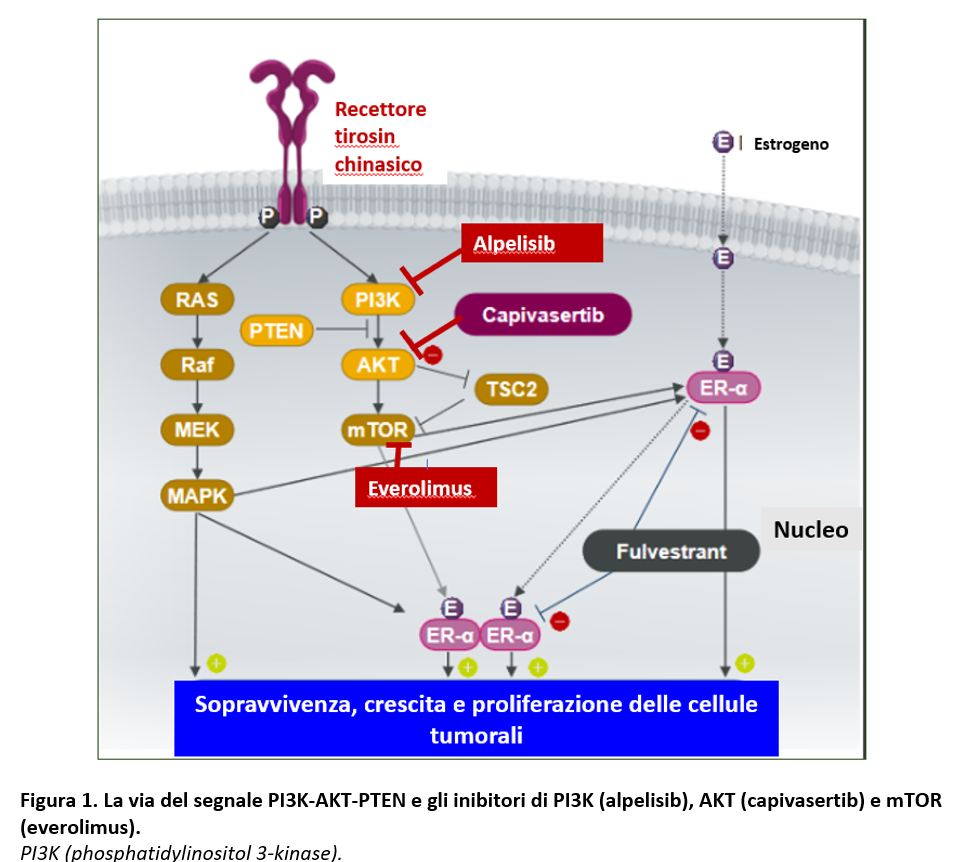
L’inibizione della via del segnale PI3K-AKT-PTEN associata a endocrinoterapia ha permesso di ottenere risultati positivi in pazienti con cancro mammario avanzato HR+/HER2-negativo pretrattate rispetto alla solo endocrinoterapia. Alpelisib, un inibitore alfa-selettivo di PI3K, combinato con Fulvestrant in tumori con mutazione di PI3K (SOLAR 1 study) (Andrè F, 2019) e everolimus, un inibitore di mTOR, in combinazione con exemestane (studio BOLERO 2) (Piccat M, 2014; Baselga J, 2012) hanno riportato un vantaggio statisticamente e clinicamente significativo in PFS rispetto alla sola endocrinoterapia.
Capivaserib è un inibitore orale di tutte e tre le isoforme di AKT che ha evidenziato nello studio di fase 2 FAKTION, in combinazione con fulvestrant, un aumento della PFS e della OS rispetto a solo fulvestrant
(Jones RH, 2020; Howell SJ, 2022).
In questo articolo pubblicato sul NEJM 2023 è stata riportata l’analisi primaria dello studio CAPItello-291.
METODI
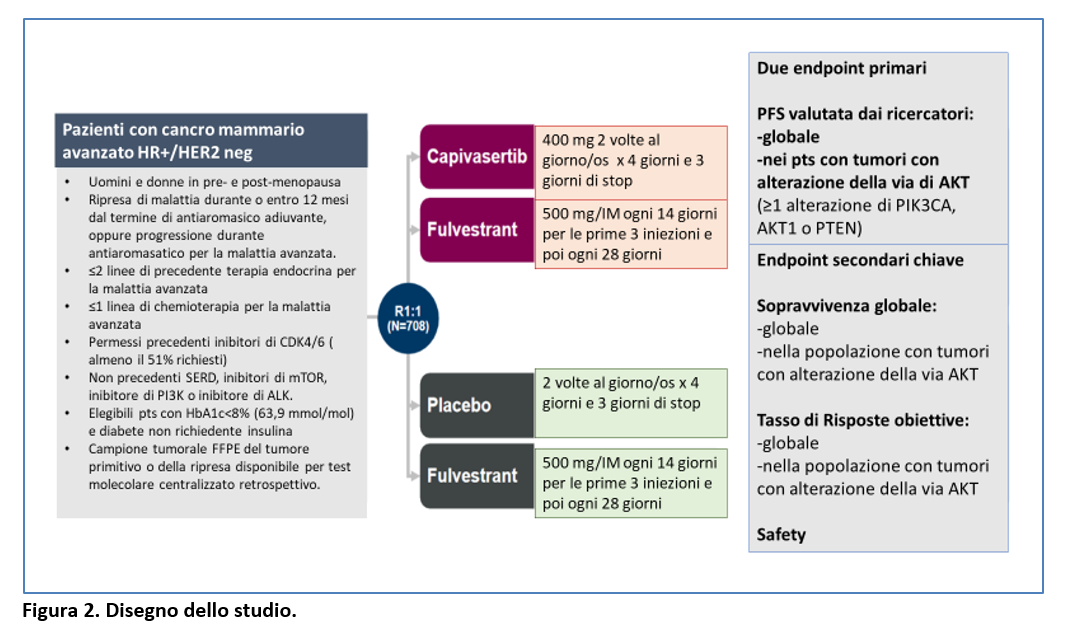
Nello studio di fase 3 CAPitello-291, doppio cieco, placebo controllato, sono stati randomizzati (1:1) pazienti a ricevere capivasertib (400 mg/os/2 volte al giorno x 4 giorni-seguiti da 3 giorni senza trattamenti) + fulvestrant (500 mg/IM ogni 14 giorni per le prime tre iniezioni e poi ogni 28 giorni) oppure placebo + fulvestrant (Figura 2).
Il trattamento veniva continuato fino a progressione (valutata secondo RECIST v.1.1), comparsa di effetti collaterali inaccettabili, ritiro del consenso o decesso.
Erano previste riduzioni di dose del capivasertib.
I criteri di eligibilità sono riportati nella Figura 2.
L’endpoint primario era la PFS valutata dai ricercatori nella popolazione globale (n=708 pts) e nei pazienti con tumori con alterazioni della via AKT (n=289 pts).
RISULTATI
Da giugno 2020 a ottobre 2021 sono stati randomizzati 708 pazienti: 289 (=40,8%) avevano tumori con alterazioni della via AKT.
Le caratteristiche basali delle pazienti erano ben bilanciate nella popolazione globale e nella popolazione con alterazione della via AKT. L’età mediana dei pazienti era 58 anni (range 26-90) e il 77,3% erano donne in post-menopausa.
Tutti i pazienti avevano un tumore HER2-negativo e il 69,1% aveva ricevuto precedentemente un inibitore di CDK4/6; il 18,2% aveva ricevuto una chemioterapia per la malattia avanzata.
Alla analisi primaria (data cutoff: 15 agosto 2022), 63 pazienti (17,7%) stavano continuando ad assumere capivasertib-fulvestrant e 43 (12,3%) placebo-fulvestrant.
La durata mediana del trattamento con capivasertib-fulvestrant è stata di 5,8 mesi e di 3,7 mesi quella con placebo-fulvestrant.
L’analisi primaria è stata condotta dopo 551 eventi di progressione o morte (258 eventi nel gruppo capivasertib-fulvestrant vs 293 nel gruppo placebo+fulvestrant).
La PFS mediana nella popolazione globale valutata dai ricercatori, è stata di 7,2 mesi (95% CI 5,5-7,4) nel gruppo capivasertib-fulvestrant e di 3,6 mesi (95% CI 2,8-3,7) nel gruppo placebo-fulvestrant, con HR per progressione o morte di 0,60 (95% CI 0,51-0,71; p<0,001) (Figura 3.).
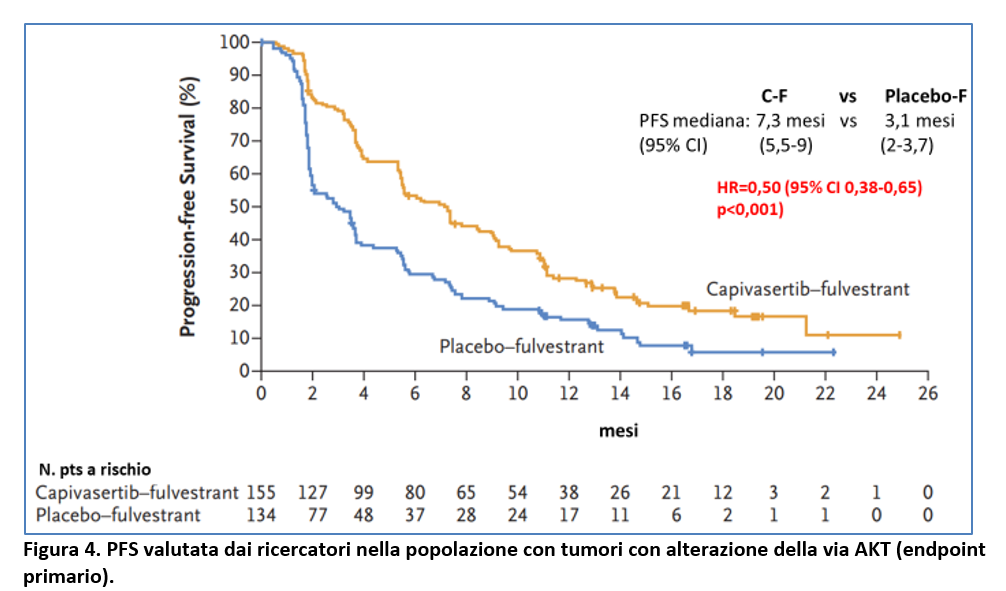
La PFS nella popolazione con tumore con alterazioni della via AKT (alterazioni di PIK3CA, AKT1 o PTEN) è stata di 7,3 mesi con capivasertib-fulvestrant (95% CI 5,5-9) e di 3,1 mesi con placebo-fulvestrant (95% CI 2-3,7) con HR=0,50 (95% CI 0,38-0,65; p<0,001) (Figura 4).
Nella popolazione globale, la PFS è risultata a favore del gruppo capivasertib-fulvestrant in tutti i sottogruppi, anche nel sottogruppo precedentemente trattato con CDK4/6 inibitori e nel sottogruppo non precedentemente trattato con CDK4/6i.
Al momento dell’analisi, 195 pazienti del gruppo capivasertib-fulvestrant erano decedute (27,5%) e 108 del gruppo placebo-fulvestrant. La sopravvivenza globale a 18 mesi è stata del 73,9% (95% CI, 68,3-78,7) nel gruppo capivasertib-fulvestrant e 65% (95% CI 58,7-70,6) nel gruppo placebo-fulvetsrant nella popolazione globale (HR=0,74; 95% CI 0,56-0,98).
Nel gruppo di pazienti con tumori con alterazioni della via AKT, la sopravvivenza globale a 18 mesi è stata del 73,2% (64,8-80) vs 62,9% (53,1-71,2) con HR=0,69 (95% CI 0,45-1,05).
Alla data del cutoff (15 agosto 2022) non è ancora stato raggiunto un numero di morti sufficienti per poter eseguire una analisi formale della sopravvivenza globale.
Gli eventi avversi più frequenti di grado ≥3 nei pazienti trattati con capivasertib-fulvestrant sono stati rash (12,1% dei pazienti vs 0,3% dei pazienti del gruppo placebo-fulvestrant) e diarrea (9,3% vs 0,3%).
Gli eventi avversi hanno portato a interruzione del trattamento nel 13% dei pazienti che ricevevano capivasertib-fulvestrant e nel 2,3% dei pazienti che ricevevano placebo-fulvestrant.
CONCLUSIONI
La terapia con capivasertib-fulvestrant ha determinato una più lunga PFS rispetto al placebo-fulvestant, statisticamente significativa, in pazienti con cancro mammario avanzato HR+/HER2-negativo, progredito durante o dopo endocrinoterapia con o senza inibitori di CDK4/6.

BIBLIOGRAFIA
André F, Ciruelos E, Rubovszky G, et al. Alpelisib for PIK3CA-mutated, hormone receptor–positive advanced breast cancer. N Engl J Med 2019;380:1929-40.
Piccart M, Hortobagyi GN, Campone M, et al. Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: overall survival results from BOLERO-2. Ann Oncol 2014; 25:2357-62.
Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal hormonereceptor–positive advanced breast cancer. N Engl J Med 2012;366:520-9
Jones RH, Casbard A, Carucci M, et al. Fulvestrant plus capivasertib versus placebo after relapse or progression on an aromatase inhibitor in metastatic, oestrogen receptor-positive breast cancer (FAKTION): a multicentre, randomised, controlled, phase 2 trial. Lancet Oncol 2020;21:345- 57.
Howell SJ, Casbard A, Carucci M, et al. Fulvestrant plus capivasertib versus placebo after relapse or progression on an aromatase inhibitor in metastatic, oestrogen receptor-positive, HER2-negative breast cancer (FAKTION): overall survival, updated progression-free survival, and expanded biomarker analysis from a randomised, phase 2 trial. Lancet Oncol 2022;23:851-64
Link all’abstract:
https://pubmed.ncbi.nlm.nih.gov/37256976/


