STUDIO NATALEEE: ribociclib adiuvante nel carcinoma mammario
-
Durante il congresso tenutosi a Chicago a giugno 2023, sono stati presentati i risultati dello studio NATALEE
Ribociclib and endocrine therapy as adjuvant treatment in patients with HR+/HER2- early breast cancer: primary results from the Phase III NATALEE trial.
SLAMON D et al. J Clin Oncol. 2023;41_suppl 17:LBA500
Circa l’80% dei nuovi casi di carcinoma mammario sono forme non metastatiche (Early Breast Cancer-EBC) e di queste circa il 70-75%, sono rappresentati da carcinomi HR+/HER2-negativi. Il 32% dei pazienti con HR+/HER2-negativi hanno uno STADIO II di malattia, mentre più bassa è la percentuale dei pazienti STADIO III. L’obiettivo del trattamento dell’EBC (chirurgia ± radioterapia adiuvante, endocrinoterapia adiuvante± chemioterapia) è la guarigione del paziente. Tuttavia, anche dopo aver ricevuto una terapia endocrina adiuvante, il 27-37% dei pazienti STADIO II e oltre il 50% dei pazienti stadio III presenta una ripresa a distanza di malattia a 20 anni dalla diagnosi (PAN H. et al. NEJM 2017; 377: 1836-1846).
In considerazione dei risultati ottenuti con ribociclib nelle forme avanzate di carcinoma mammario, è stato disegnato lo studio clinico NATALEE. Lo studio NATALEE è uno studio di fase 3 che ha randomizzato 5.101 pazienti (uomini e donne pre/post-menopausa) in stadio patologico II e III con carcinoma mammario HR+/HER2-negativo in fase precoce. I pazienti sono stati randomizzati (1:1) a ricevere ribociclib (400 mg/os /die per 3 settimane àuna settimana di sospensione) associato a inibitore non steroideo dell’aromatasi (letrozolo o anastrozolo) oppure solo ormonoterapia adiuvante. Gli uomini e le donne in pre-menopausa ricevevano anche Goserelin (3,6 gr/IM ogni 28 giorni). Il RIBOCICLIB veniva somministrato per 3 anni e dell’aromatasi per ≥ 5 anni.
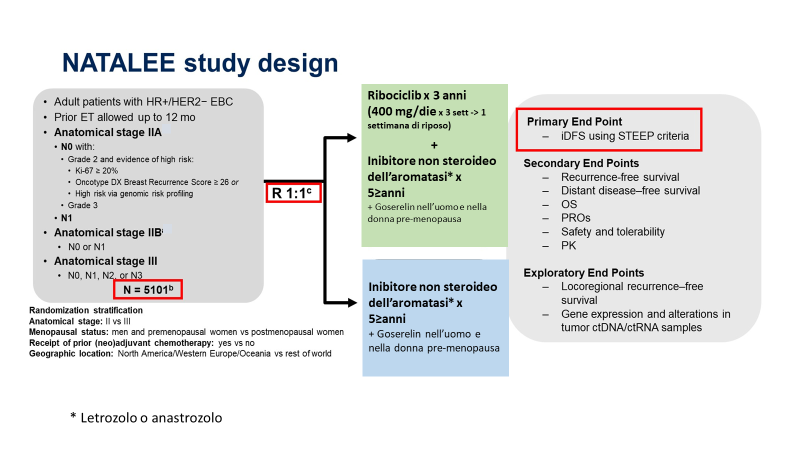
L’endpoint primario dello studio era l’invasive-DFS. Nella tabella 1 sono ripotati i criteri di eleggibilità.
Tabella 1-Pazienti eleggibili per il NATALEE (stadio II-III). 
Nello studio NATALEE sono stati arruolati 20 uomini (0,4%). Circa il 44% delle donne arruolate erano in pre-menopausa e il 56% in post-menopausa. Il 20% dei pazienti era in stadio patologico II A, il 20% II B e il 60% III. Il 41% dei pazienti aveva ricevuto chemioterapia in (neo)-adiuvante. Ad un follow up mediano di 27,7 mesi (quando solo il 20% dei pazienti aveva completato i 3 anni di ribociclib), è stata effettuata la 2° interim analysis con 426 eventi per la iDFS, che ha riportato un vantaggio statisticamente significativo in iDFS con ribociclib (3y iDFS: 90,4% vs 87,1%) con un beneficio assoluto a 3 anni del 3,3%. Il rischio di malattia invasiva è stato ridotta del 25,2% dall’aggiunta del ribociclib all’ormonoterapia adiuvante con HR=0,748, 95% CI 0,618-0,906. Il beneficio in iDFS è risultato consistente in tutti i sottogruppi di pazienti pre-specificati.
Anche per l’endpoint secondario distant-DFS, è stato evidenziato un vantaggio statisticamente significativo con l’aggiunta di ribociclib, con una DDFS a 3 anni pari al 90,8% vs 88,6% (HR 0,739; 95% CI 0,603-0,905;p=0.0017) e con un beneficio assoluto a 3 anni del 2,2%.
Ad un follow up mediano di 30,4 mesi sono stati registrati 61 eventi morte per il braccio Ribociclib vs 73 eventi morte per il braccio di controllo e l’overall survival (OS) non è significativa. I dati per la OS nopn sono ancora maturi.
La dose iniziale di Ribociclib di 400 mgr è stata ben tollerata. L’evento collaterale più frequente correlato a ribociclib è stato la neutropenia (qualsiasi grado: 62% vs 4,5%; di grado ≥63: 43,8% vs 0,8%), con solo lo 0,3% di neutropenia febbrile. Gli effetti collaterali più frequenti che hanno portato a discontinuazione della terapia sono stati gli eventi avversi epatici (8,9% per Ribociclib vs 0,1% per braccio della sola endocrinoterapia). Relativamente agli eventi cardiaci e polmonari, sono stati registrati prolungamenti del QT di qualsiasi grado con ribociclib nel 4,2% dei pazienti (percentuale inferiore al 6,5% riportata nello studio MONALEESA con 600 mgr di ribociclib) e di grado G3 solo nello 0,2% ( rispetto all’1,2% riportato nello studio MONALEESA). La polmonite interstiziale è stata riportata nell’1,5% dei pazienti del gruppo ribociclib, senza nessun caso di grado G3-G4.

B- All’ ESMO (20-24 ottobre 2023) sono stati presentati i risultati di una analisi esploratoria pre-specificata di sottogruppo.
Invasive disease-free survival (iDFS) cross key subgroups from the Phase III NATALEE study of ribociclib (RIB) + a nonsteroidal aromataser inhibitor (NSAI) in patients (pts) with HR+/HER2- early breast cancer (EBC). Bardia A et al, ESMO CONGRESS 2023, LBA23
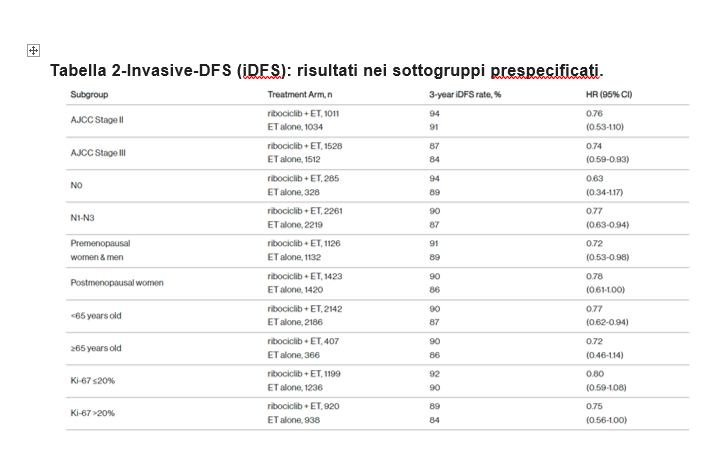
Nell’analisi di sottogruppo prespecificata dello studio NATALEE dell’invasive-DFS (iDFS), a 27,7 mesi di follow up viene evidenziato un beneficio in iDFS con ribociclib+ ormonoterapia adiuvante in tutti i sottogruppi prespecificati rispetto alla sola ormonoterapia adiuvante nei pazienti con stadio II e III HR+/HER2- EBC, inclusi i pazienti pN0 e stadio II e i pazienti ultr65enni (Tabella 2).
Si rimane in attesa dell’analisi finale di efficacia.
COMMENTO
L’aggiunta di ribociclib (alla dose iniziale di 400 mg) all’endocrinoterapia adiuvante con letrozolo o anastrozolo ha evidenziato, nello studio di fase 3 NATALEE, un vantaggio statisticamente significativo e clinicamente rilevante nelle pazienti con EBC HR+/HER2-negativo in invasive-DFS a 3 anni (beneficio assoluto pari al 3,3%), in tutta la popolazione e anche in tutti i sottogruppi prespecificati.
Anche per l’endpoint secondario distant-DFS, è stato evidenziato un vantaggio statisticamente significativo con l’aggiunta di ribociclib, con un beneficio assoluto a 3 anni del 2,2%.
Ribociclib per 3 anni alla dose iniziale di 400 mg è risultato inoltre ben tollerato.



