
FINAL, 10-YEAR OUTCOMES WITH NIVOLUMAB PLUS IPILIMUMAB IN ANDVANCED MELANOMA.
Wolchok JD, Chiarion-Sileni V, Rutkowski P, Cowey CL, Schadendorf D, Wagstaff J, Queirolo P, Dummer R, Butler MO, Hill AG, Postow MA, Gaudy-Marqueste C, Medina T, Lao CD, Walker J, Márquez-Rodas I, Haanen JBAG, Guidoboni M, Maio M, Schöffski P, Carlino MS, Sandhu S, Lebbé C, Ascierto PA, Long GV, Ritchings C, Nassar A, Askelson M, Benito MP, Wang W, Hodi FS, Larkin J; CheckMate 067 Investigators
N Engl J Med. 2025 Jan 2;392(1):11-22. doi: 10.1056/NEJMoa2407417. Epub 2024 Sep 15. PMID: 39282897.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/39282897/
I RISULTATI DELLO STUDIO CHECKMATE 067 RIPORTATI nel 2015 e nel 2017 (Larkin J, NEJM 2015; Wolchok JD, NEJM 2017)
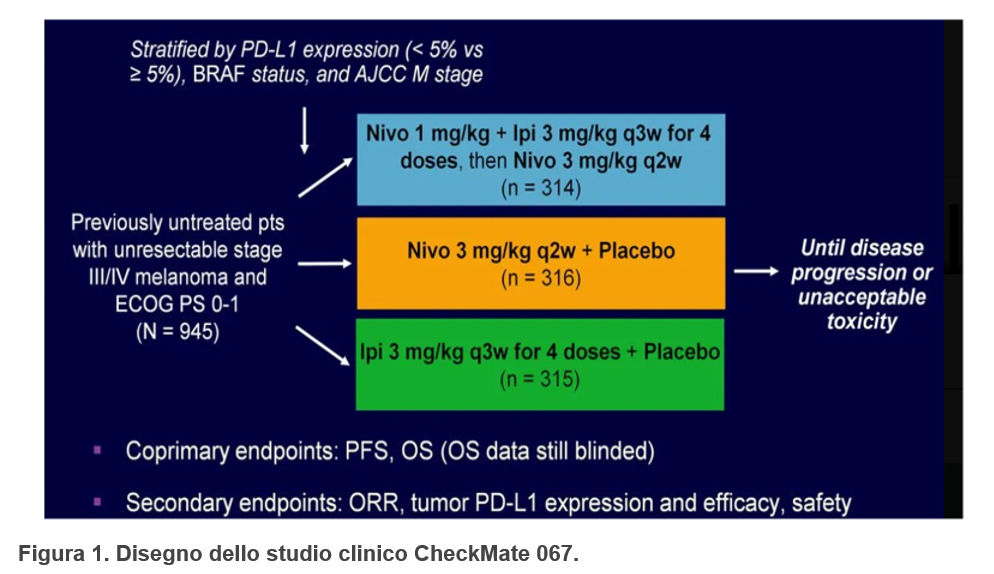
Lo studio CHECKMATE 067 è uno studio randomizzato a tre bracci in cui pazienti con melanoma stadio III non resecabile e stadio IV non pretrattati sono stati randomizzati a ricevere:
- nivolumab alla dose di 1 mg/kg + ipilimumab alla dose di 3 mg/kg ogni 3 settimane per quattro dosi, seguite da nivolumab ad una dose di 3 mg/kg ogni 2 settimane
- nivolumab ad una dose di 3 mg/kg ogni 2 settimane più placebo
- ipilimumab alla dose di 3 mg/kg ogni 3 settimane per quattro dosi più placebo
Il trattamento veniva continuato fino alla progressione, alla comparsa di effetti tossici inaccettabili o al ritiro del consenso.
La randomizzazione è stata stratificata secondo lo stato di PD-L1, lo stato della mutazione BRAF e la fase della metastasi (Figura1).
I due endpoint co-primari dello studio erano:
la PFS e la OS nel gruppo nivolumab+ipilimumab rispetto al gruppo ipilimumab e
la PFS e OS nel gruppo nivolumab vs gruppo ipilimumab.
Tra gli end point secondari era compreso il tasso di risposte obiettive valutate dai ricercatori.
La sopravvivenza libera da progressione è stata definita come il tempo intercorso tra la data di randomizzazione e la data di progressione documentata o di morte (a seconda di quale si sia verificata per prima). L’espressione di PD-L1 sulla superficie delle cellule tumorali è stata valutata in un laboratorio centralizzato mediante analisi immunoistochimica su campioni di tumore fissati in formalina e inclusi in paraffina con l’impiego di un anticorpo monoclonale di coniglio anti-PD-L1 umano (clone 28-8) con test DAKO. La positività di PD-L1 è stata definita come almeno il 5% di cellule tumorali che mostravano una colorazione PD-L1 di qualsiasi intensità sulla superficie cellulare in una sezione contenente almeno 100 cellule tumorali analizzabili.
RISULTATI
Da luglio 2013 a marzo 2014, sono stati randomizzati a livello internazionale (Australia, Europa, Israele, Nuova Zelanda e Nord America) 945 pazienti: 314 sono stati assegnati al gruppo nivolumab+ipilimumab , 316 al gruppo nivolumab e 315 al gruppo ipilimumab.
Le caratteristiche di base erano ben bilanciate tra i tre gruppi. Il 58% dei pazienti aveva uno stadio di malattia M1c, il 36,1% aveva un livello elevato di LDH, il 31,5% aveva una mutazione BRAF e il 23,6% aveva una malattia PD-L1- positiva.
I risultati relativi alla PFS (ad un follow up di 12 mesi) (Larkin J, NEJM 2015) e quelli relativi alla Overall Survival (ad un follow up minimo di 36 mesi-467 decessi totali) (Wolchok JD, NEJM 2017) sono riportati nella Tabella 1 ed evidenziano un vantaggio della combinazione NIVO+IPI rispetto a Ipilimumab e del Nivolumab rispetto a ipilimumab.

Il tasso di risposte obiettive (end point secondario) ad un follow up di 36 mesi (Wolchok JD, NEJM 2017), è stato maggiore nel gruppo di pazienti trattati con NIVOLUMAB+IPILIMUMAB rispetto al gruppo NIVOLUMB: 58% vs 44% ; nel gruppo IPILIMUMAB il tasso di risposte obiettive è stato pari al 19%.
Il tasso di risposte complete è stato 19% nel gruppo di combinazione, 16% nel gruppo NIVO e 5% nel gruppo IPI. La durata mediana della risposta non è stata raggiunta nel gruppo COMBO né nel gruppo NIVO ed è stata di 19,3 mesi nel gruppo IPI.
Per quanto riguarda la SAFETY, eventi avversi di grado 3-4 si sono osservati nel 55% dei pazienti trattati on NIVOLUMAB+IPILIMUMAB, nel 16,3% del NIVOLUMAB e nel 27,3% dell’IPILIMUMA (Larkin J, NEJM 2015).
I più frequenti eventi avversi di grado 3-4 correlati al trattamento sono stati:
diarrea (9,3% Nivolumab+ipilimumab, 2,2% Nivolumab e 6,15 Ipilimumab),
colite ( 7,7%, 0,6%, 8,7% rispettivamente),
e aumento dei valori della alanino- aminotransferasi (8,3%, 1,3% e 1,6% rispettivamente).
I RISULTATI DELLO STUDIO CHECKMATE 067 A 10 anni (Wolchok JD, NEJM 2025)
In questo articolo sono riportati i risultati finali di efficacia e safety ad un follow up minimo di 10 anni dalla data di randomizzazione dell’ultimo paziente arruolato nello studio. Vengono riportati i risultati relativi all’outcome dei pazienti che erano vivi e liberi da progressione a 3 anni.
Alla chiusura finale del data-base (16 maggio 2024), il follow up minimo dalla data di randomizzazione dell’ultimo paziente arruolato è stata di 120 mesi, con follow up mediano di 57,5 mesi (range 0,1-128,1) nel gruppo IPI+NIVO, 36 mesi (range 0-128,1) nel gruppo NIVO e 18,6 mesi (range 0-127,2) nel gruppo IPI.
La sopravvivenza globale è stata più lunga nel gruppo NIVO-IPI e nel gruppo NIVO rispetto al gruppo IPI (Figura 2).
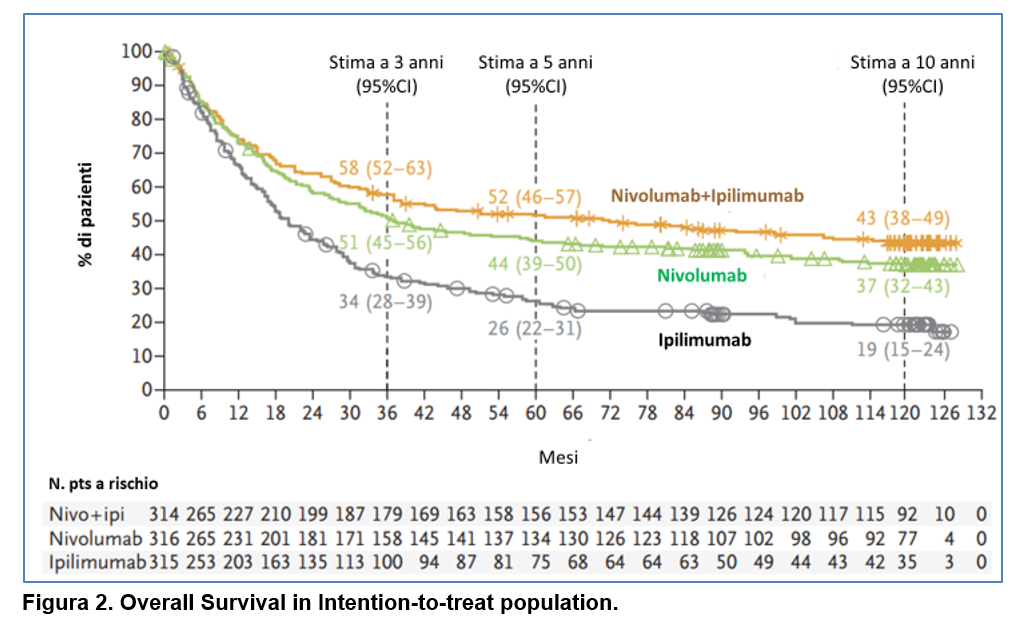
La sopravvivenza globale è stata di:
– 71,9 mesi (95% CI : 38,2-114,4) con NIVO-IPI;
-36,9 mesi (95% CI : 28,2-58,7) con NIVO;
-19,9 mesi (95% CI : 16,8-24,6) con IPI (Figura 2), c
con HR per rischio di morte pari:
a 0,53 (95% CI 0,44-0,65) per NIVO-IPI rispetto a IPILIMUMAB
a 0,63 (95% CI 0,69-1,05) per NIVOLUMAB rispetto a IPILIMUMAB.
In una analisi descrittiva, l’HR per rischio di morte è stato pari a 0,85 (95% CI 0,69-1,05) per NIVO-IPI rispetto a NIVOLUMAB.
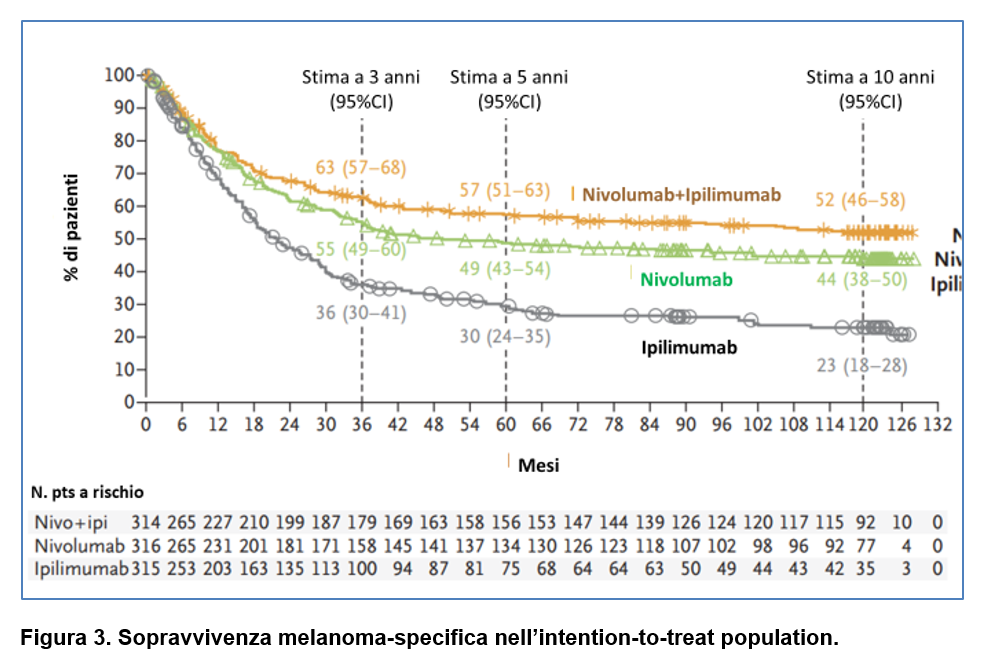
La sopravvivenza melanoma-specifica è stata numericamente più lunga nel gruppo NIVO-IPI e nel gruppo NIVO rispetto al gruppo IPILIMUMAB (Figura 3), con una mediana di:
- 120 mesi (95% CI 71,8-NR) con NIVO-IPI e con 37% di pazienti vivi alla fine dello studio;
- 49,4 mesi (95% CI 35,1-119,4) con NIVO;
- 21,9 mesi (95% CI 18,1-27,4) con IPI.
La sopravvivenza melanoma-specifica a 10 anni è stata:
- 52% con NIVO-IPI;
- 44% con NIVO;
- 23% con IPILIMUMAB (analisi descrittiva).
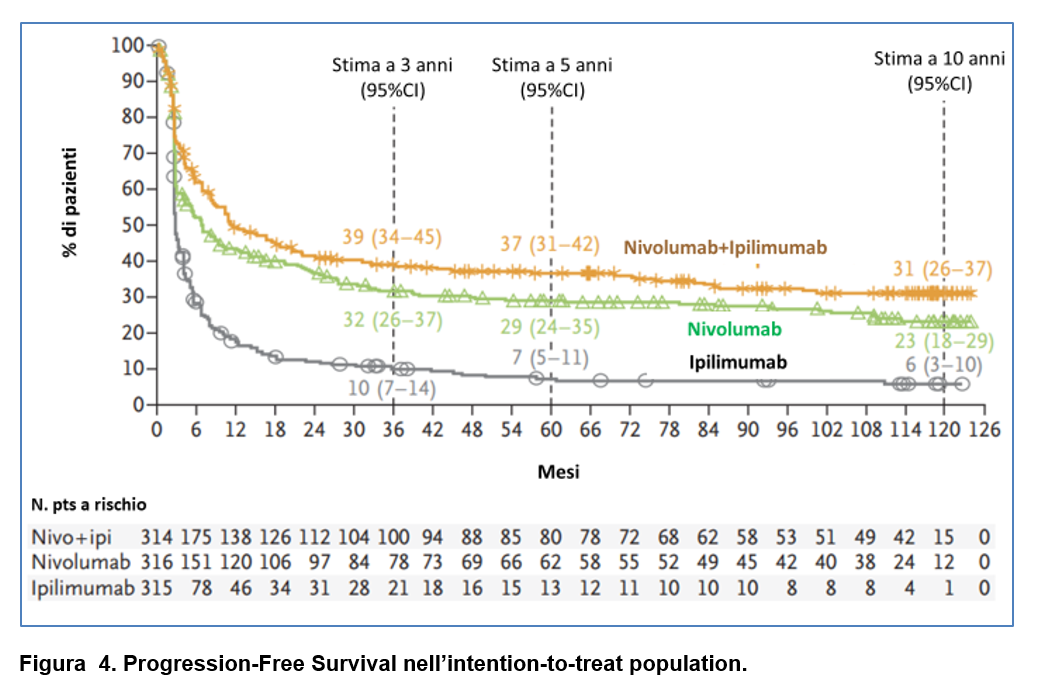
Nella Figura 4 viene riportata la Progression-Free Survival nell’intention-to-treat population: la PFS non è cambiata con un “plateau” delle curve dopo 3 anni .
Tra i pazienti sottoposti a randomizzazione, la sede più comune di progressione è stata quella linfonodale (in 58 pazienti-18%- nel gruppo NIVO-IPI; in 79 pazienti -25%- nel gruppo NIVO; in 111 pazienti -35%- nel gruppo IPI). Il sistema nervoso centrale è stata la sedi di progressione in:
- 15 pazienti (5%) nel gruppo NIVO-IPI;
- in 20 pazienti (6%) nel gruppo NIVO;
- in 28 pazienti (9%) nel gruppo IPI.
Oltre i 3 anni di follow up si sono verificati 38 eventi complessivi complessivi in tutti e 3 i gruppi:
- 19 nuove progressioni;
- 2 decessi da melanoma senza documentata progressione,
- 17 decessi da cause non collegate a melanoma, senza documentata progressione.
SOPRAVVIVENZA IN ALCUNI SOTTOGRUPPI
A 10 anni, la Sopravvivenza globale (OS) e la sopravvivenza melanoma-specifica sono risultate più lunghe nel gruppo NIVO-IPI e nel gruppo NIVO rispetto al gruppo IPI sia nei sottogruppi stratificati in base allo stato mutazionale di BRAF (Figura 5) e all’espressione di PD-L1 che negli altri sottogruppi specificati.
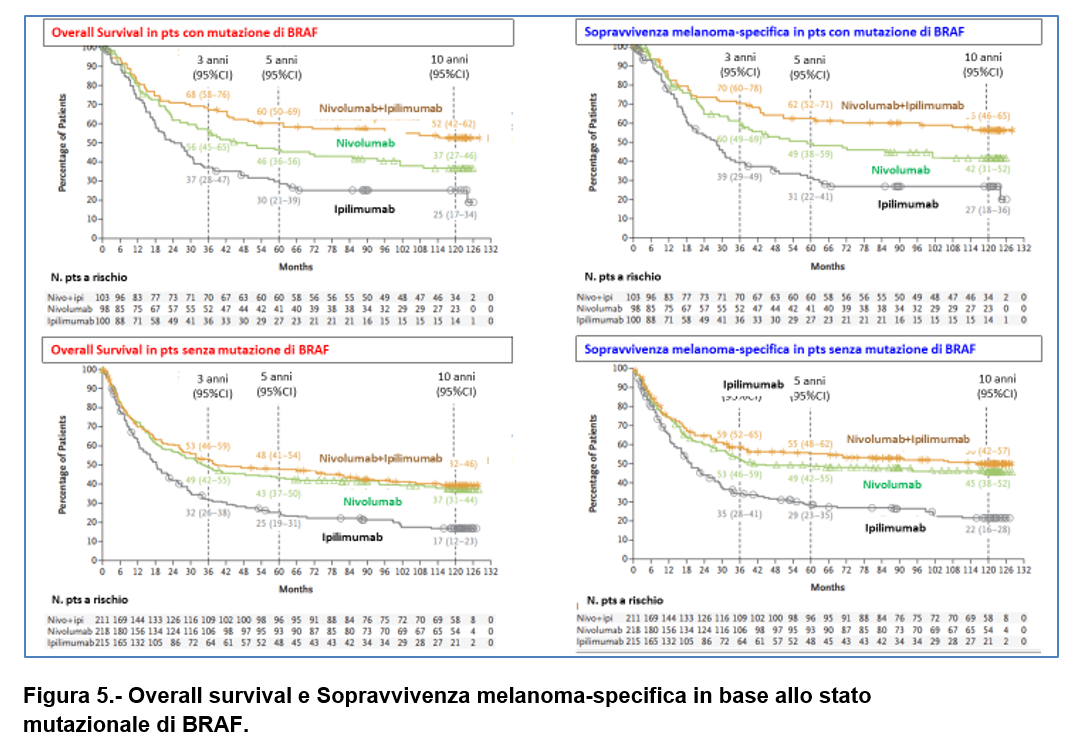
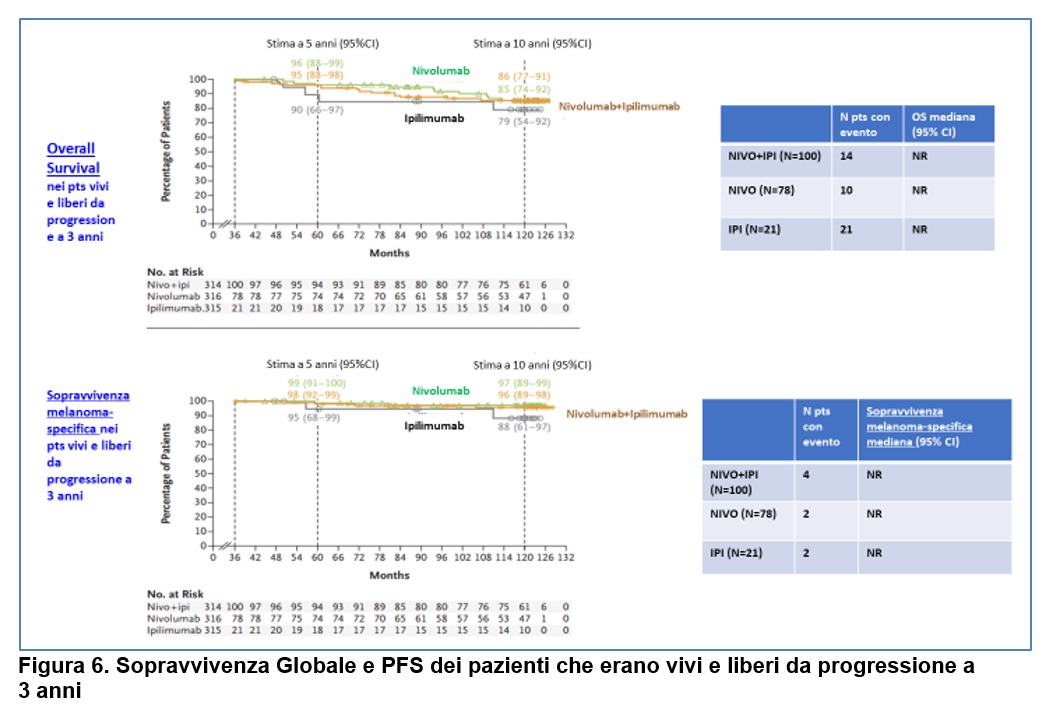
Tra i pazienti che erano vivi e liberi da progressione a 3 anni (100 pts nel gruppo NIVO-IPI; 78 nel gruppo NIVO e 21 nel gruppo IPI),
la OS a 10 anni è stata pari a:
- 86% con NIVO+IPI;
- 85% con NIVO;
- 79% con IPI (Figura 6)
e la sopravvivenza melanoma-specifica è stata pari a:
- 96% con NIVO+IPI;
- 97% con NIVO;
- 88% con IPI (Figura 6).
SAFETY
Non sono stati osservate nuove tossicità né nuovi decessi correlati al trattamento.
CONCLUSIONI
I risultati finali dello studio CHECKMATE 067 continuano a dimostrare un beneficio in sopravvivenza con NIVO-IPI e con NIVO, rispetto a IPILIMUMAB in monoterapia, nei pazienti con melanoma avanzato.
COMMENTO
In Italia, dall’autunno 2022 Ipilimumab in associazione a Nivolumab è rimborsato negli adulti e negli adolescenti di eta’ pari o superiore a dodici anni, per il trattamento del melanoma metastatico in presenza di metastasi cerebrali asintomatiche o con PD-L1< 1% (DETERMINA AIFA del 24 ottobre 2022 n. 773/2022; GU n.256 del 2-11-2022).
Da giugno 2024, Ipilimumab in associazione a nivolumab è rimborsato per il trattamento del melanoma avanzato (non resecabile o metastatico) negli adulti e negli adolescenti di eta’ pari o superiore a dodici anni (Determina AIFA n. 133/2024 del 7 giugno 2024– GU n.140 del 17-6-2024)
Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015;373:23-34.
Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017; 377:1345-56.


