
SURVIVAL WITH CEMIPLIMAB IN RECURRENT CERVICAL CANCER.
Tewari KS, Monk BJ, Vergote I, Miller A, de Melo AC, Kim HS, Kim YM, Lisyanskaya A, Samouëlian V, Lorusso D, Damian F, Chang CL, Gotovkin EA, Takahashi S, Ramone D, Pikiel J, Maćkowiak-Matejczyk B, Guerra Alía EM, Colombo N, Makarova Y, Rischin D, Lheureux S, Hasegawa K, Fujiwara K, Li J, Jamil S, Jankovic V, Chen CI, Seebach F, Weinreich DM, Yancopoulos GD, Lowy I, Mathias M, Fury MG, Oaknin A; Investigators for GOG Protocol 3016 and ENGOT Protocol En-Cx9.
N Engl J Med. 2022 Feb 10;386(6):544-555
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/35139273/
In base ai risultati dello studio clinico di fase 3 EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9, da Luglio 2024, in Italia, cemiplimab in monoterapia è indicato e rimborsato da AIFA per il trattamento di pazienti adulte con carcinoma della cervice uterina recidivato o metastatico, con espressione di PD-L1 ≥1% e in progressione di malattia durante o dopo un precedente trattamento con chemioterapia a base di platino.
Nonostante la disponibilità di programmi di screening tramite Pap test e la compagna di vaccinazione anti-HPV, i tassi di incidenza e di mortalità per carcinoma della cervice uterina nel mondo risultano ancora alti (rispettivamente 600.000 nuovi casi /anno con 350.000 morti/anno).
Il trattamento standard di prima linea del carcinoma della cervice uterina in stadio avanzato de novo o recidivato dopo trattamento curativo è rappresentato dalla combinazione di chemioterapia a base di sali del platino, con o senza l’anticorpo monoclonale anti-VEGF bevacizumab, a cui nei casi di malattia con PD-L1 CPS≥1 viene aggiunta immunoterapia con pembrolizumab (anticorpo monoclonale anti-PD-1). Nonostante l’incremento della sopravvivenza derivante da tali trattamenti, le opzioni terapeutiche dalla seconda linea in poi rimangono limitate e poco efficaci. Cemiplimab, un anticorpo anti-PD-1, ha dimostrato di avere un’attività clinica in questa popolazione di pazienti.
DISEGNO DELLO STUDIO EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9
Lo studio di fase 3 (EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9) ha randomizzato (1:1) pazienti in progressione di malattia dopo chemioterapia contenente platino a ricevere cemiplimab (350 mg ev ogni 3 settimane) o una mono-chemioterapia a scelta dello sperimentatore [tra pemetrexed, un inibitore della topoisomerasi (topotecano o irinotecano), gemcitabina o vinorelbina], indipendentemente dal livello di espressione di PD-L1. Il trattamento con cemiplimab poteva essere somministrato fino ad un massimo di 96 settimane con l’opzione di un ri-trattamento per i pazienti che avevano eseguito 16 cicli di terapia ed erano andati in progressione nel periodo di follow-up. L’endpoint primario era la sopravvivenza globale; mentre tra gli endpoints secondari si segnalano la sopravvivenza libera da progressione, la safety e la qualità di vita. Il follow-up mediano è stato di circa 18 mesi.
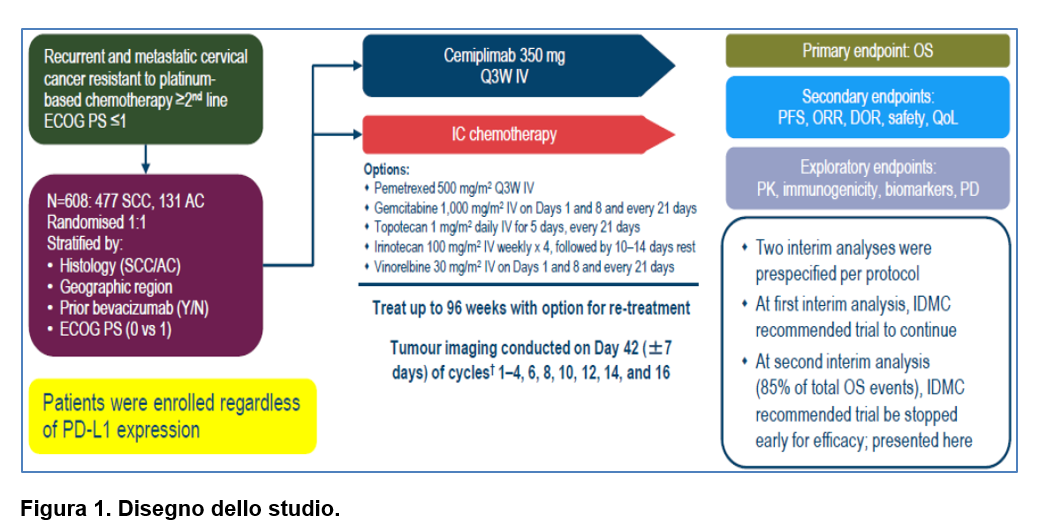
Da luglio 2017 ad agosto 2020, sono state randomizzate 608 pazienti, di cui 304 in ciascuno dei due gruppi. Da segnalare che in più del 90% dei casi si trattava di malattia metastatica de novo, che quasi il 60% delle pazienti aveva ricevuto una linea di terapia nel setting metastatico o per la recidiva e che circa il 90% aveva precedentemente ricevuto un taxano mentre il 50% terapia con anti-angiogenetico. Non era consentita precedente immunoterapia con anticorpo anti-PD-1 o anti-PD-L1.
RISULTATI
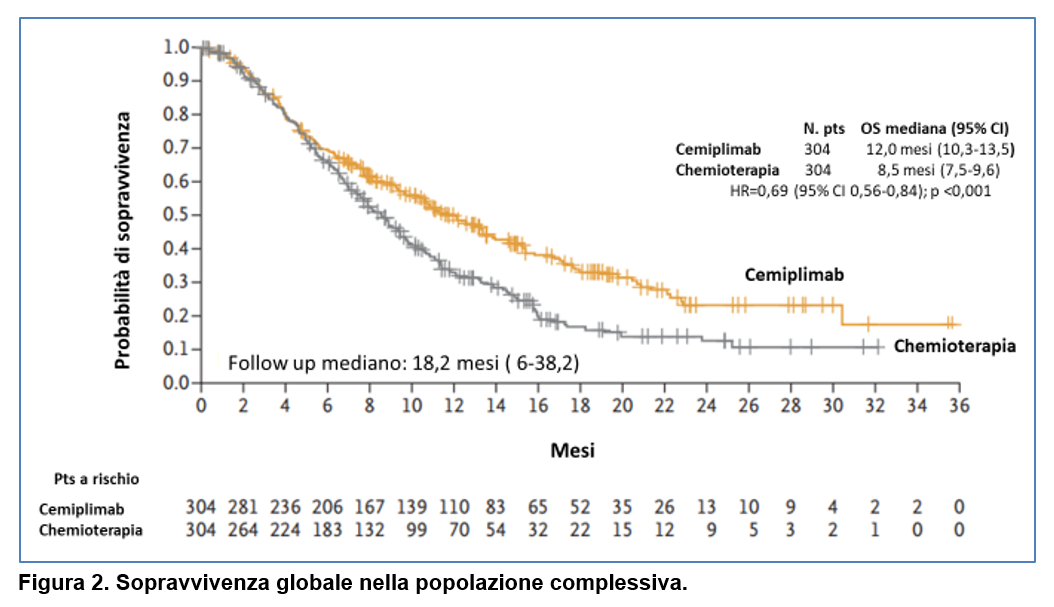
Nella popolazione complessiva dello studio, la sopravvivenza globale mediana è stata più lunga nel gruppo cemiplimab rispetto al gruppo di trattamento con chemioterapia (12 mesi versus 8,5 mesi; HR 0,69, 95%CI 0,.56-0,84, p<0.001) (Figura 2).
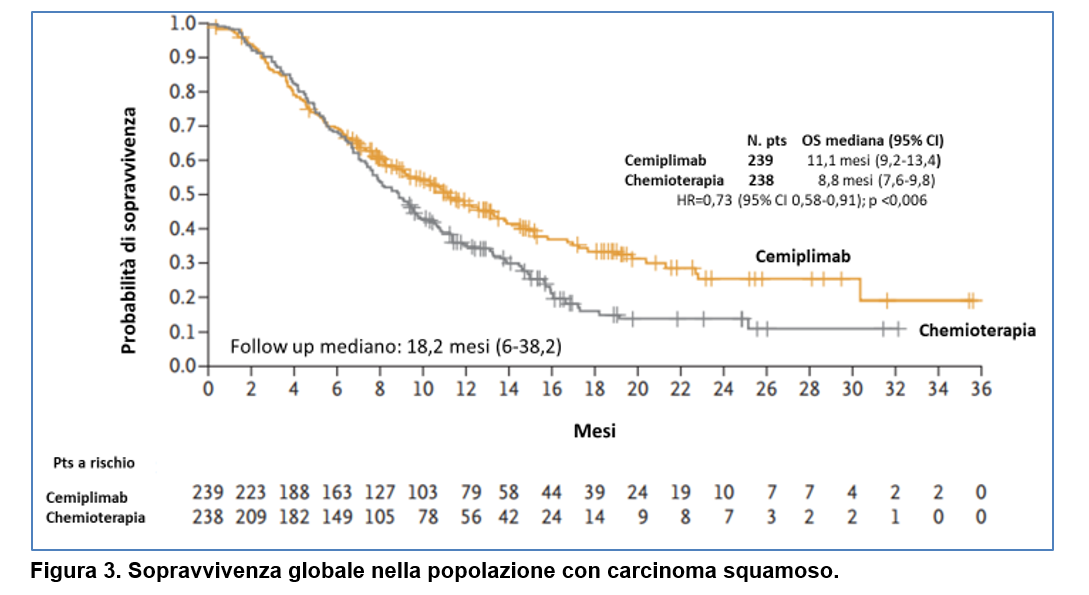
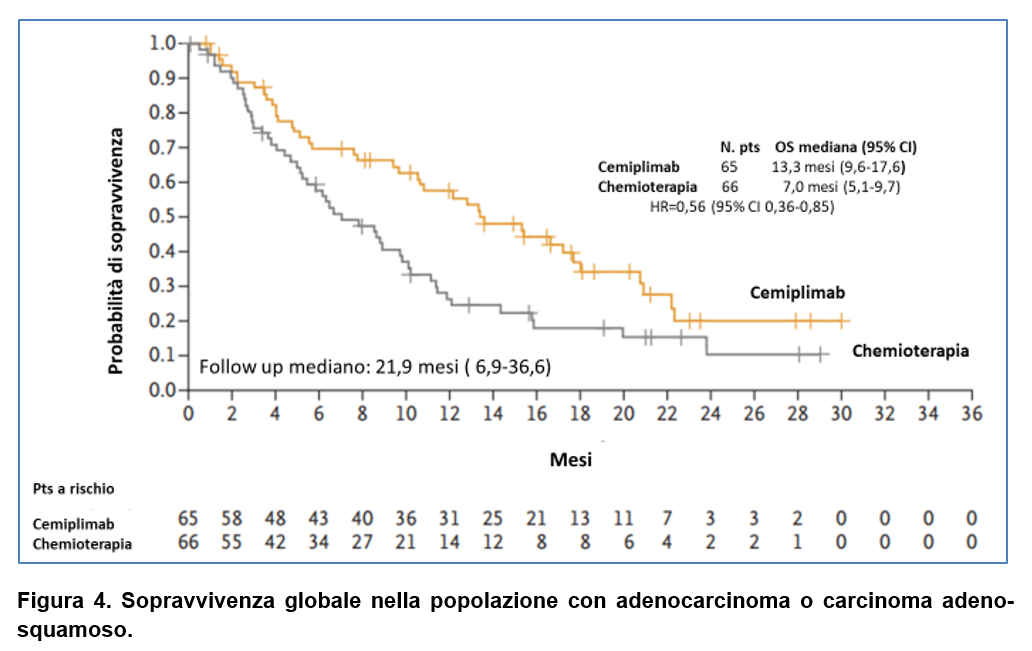
Il beneficio in sopravvivenza globale è stato consistente in entrambi i sottogruppi istologici (carcinoma squamoso e adenocarcinoma, compreso il carcinoma adeno-squamoso) (Figura 3 e Figura 4).
Anche la sopravvivenza libera da progressione e la risposta obiettiva sono risultate più lunghe nel gruppo cemiplimab rispetto al gruppo con chemioterapia nella popolazione generale [rispettivamente, PFS: HR 0.75; IC 95%, 0.63-0.89; p<0.001; ORR: 16.4% (95% CI, 12.5-21.1) versus 6.3% (95% CI, 3.8-9.6)].
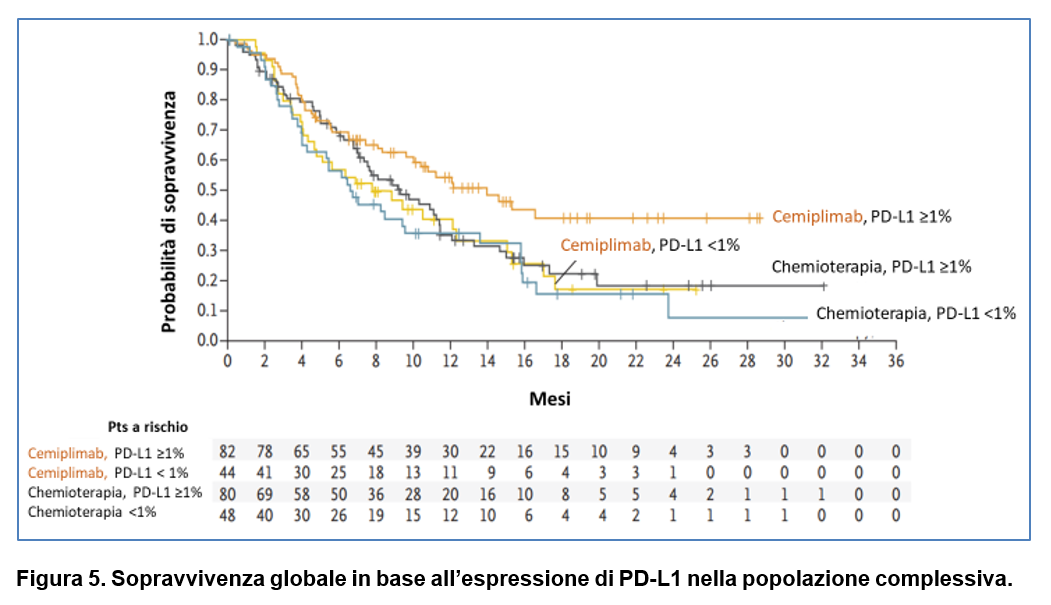
Delle 608 pazienti randomizzate, è stato possibile valutare l’espressione di PD-L1 in 254 pazienti totali: in 126 del gruppo di trattamento con cemiplimab e in 128 del gruppo chemioterapia.
In queste sottopopolazioni di pazienti sono stati evidenziati outcomes simili a quelli osservati nella popolazione complessiva.
Tra le pazienti con PD-L1 ≥1%, la mediana di sopravvivenza globale è risultata di 13,.9 mesi (95% CI, 9,6 – non raggiunta) con cemiplimab e di 9,3 mesi (95% CI, 7-11,4) con la chemioterapia (HR 0,70; 95% CI 0,46-1,05). Tra le pazienti con PD-L1 <1%, la mediana di sopravvivenza globale è risultata di 7.7 mesi (95% CI, 4,3-12,3) con cemiplimab e di 6,7 mesi (95% CI, 3,9-9,5) con la chemioterapia (HR 0,98; 95% CI 0,59-1,62) (Figura 5).
In una successiva analisi dello studio sono stati inoltre riportati i patient-reported outcomes (Oaknin A, 2022). Cemiplimab ha dimostrato di migliorare lo stato di salute generale/qualità di vita e il funzionamento fisico rispetto alla chemioterapia, con un beneficio dal secondo ciclo di terapia e una differenza clinicamente rilevante a favore di cemiplimab nella riduzione di appetito e nel dolore.
SAFETY
Eventi avversi si sono verificati nell’88.3% dei pazienti inclusi nel braccio di trattamento con cemiplimab e nel 91.4% di quelli nel gruppo con chemioterapia. Complessivamente, eventi avversi di grado ≥3 sono stati registrati nel 45% dei pazienti che hanno ricevuto cemiplimab e nel 53.4% di quelli che hanno ricevuto chemioterapia. Gli eventi avversi di grado ≥3 più comuni sono stati l’anemia (12% nel gruppo cemiplimab e 26,9% in quello con chemioterapia), le infezioni delle vie urinarie (5% e 2,8%) e la neuropatia (1% e 9%). Gli eventi avversi immuno-relati si sono verificati nel 15,7% dei pazienti trattati nel braccio cemiplimab e nel 0,7% di quelli nel braccio con chemioterapia. Nell’8,7% delle pazienti in terapia con cemiplimab e nel 5,2% di quelle che hanno ricevuto chemioterapia si sono verificati eventi tali da interrompere il trattamento. Nessuna morte è stata considerata correlata all’utilizzo di cemiplimab.
CONCLUSIONI
Nello studio EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9 l’utilizzo di cemiplimab nelle pazienti con carcinoma della cervice uterina avanzato o recidivato e progredite dopo chemioterapia a base di platino ha dimostrato un vantaggio in sopravvivenza globale rispetto alla mono-chemioterapia di 3,5 mesi, indipendentemente dall’istotipo e dall’espressione di PD-L1. Da notare che tale vantaggio è numericamente molto simile a quello dato dal bevacizumab associato alla chemioterapia in prima linea (+ 3,7 mesi in sopravvivenza globale mediana).
COMMENTO a cura della Drssa Alessandra Modena, Oncologia Medica, IRCCS Sacro Cuore Don Calabria di Negrar
In base ai risultati dello studio clinico di fase 3 EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9, da Luglio 2024, in Italia, cemiplimab in monoterapia è indicato e rimborsato da AIFA per il trattamento di pazienti adulte con carcinoma della cervice uterina recidivato o metastatico, con espressione di PD-L1 ≥1% e in progressione di malattia durante o dopo un precedente trattamento con chemioterapia a base di platino.
BIBLIOGRAFIA:
Survival with Cemiplimab in recurrent cervical cancer. Tewari KS et al., NEJM 2022; 386(6): 544-555.
EMPOWER CERVICAL-1: Effect of cemiplimab versus chemotherapy on patirent-reported quality of life, functioning and symptoms among women with recurrent cervical cancer. Oaknin A et al., EJC 2022; 174: 299-309.


