RIBOCICLIB PLUS ENDOCRINE THERAPY IN EARLY BREAST CANCER.
Slamon D, Lipatov O, Nowecki Z, McAndrew N, Kukielka-Budny B, Stroyakovskiy D, Yardley DA, Huang CS, Fasching PA, Crown J, Bardia A, Chia S, Im SA, Ruiz-Borrego M, Loi S, Xu B, Hurvitz S, Barrios C, Untch M, Moroose R, Visco F, Afenjar K, Fresco R, Severin I, Ji Y, Ghaznawi F, Li Z, Zarate JP, Chakravartty A, Taran T, Hortobagyi G.
N Engl J Med. 2024 Mar 21;390(12):1080-1091. doi: 10.1056/NEJMoa2305488.
Link all’abstact: https://pubmed.ncbi.nlm.nih.gov/38507751/

INTRODUZIONE
La maggior parte dei carcinomi mammari vengono diagnosticati in fase precoce e il tumore HR+/HER2 -negativo rappresenta il sottotipo più frequente (70-75% dei casi). Gli stadi I-II-III dei carcinoma mammari HR+/HER2-negativi vengono trattati con trattamenti locoregionali (chirurgia, radioterapia) e con terapia sistemica adiuvante (chemioterapia ± endocrinoterapia x 5 anni o più, in base al rischio) al fine di ridurre il rischio di ripresa di malattia. Dopo 5 anni di endocrinoterapia, il 27-37% dei pazienti Stadio II e il 46-57% dei pazienti Stadio III presenta una ripresa di malattia fino a 20 anni dopo la diagnosi (Pan H, 2017). In considerazione dei dati di efficacia in PFS e OS riportati con ribociclib+ endocrinoterapia nel setting metatatico, è stata valutata questa combinazione anche nel setting adiuvante (studio NATALEE).
Lo studio NATALEE di fase 3 ha confrontato ribociclib+ endocrinoterapia adiuvante rispetto a sola endocrinoterapia adiuvante in pazienti con carcinoma mammario HR+/HER2-negativo STADIO II (che rappresentano circa il 50% dei carcinomi HR+/HER2-negativi diagnosticati) o STADIO III (che rappresentano circa il 30% dei carcinomi HR+/HER2-negativi) (Slamon DJ, 2023).
Nell’articolo pubblicato da Slamon D et al. nel NEJM di marzo 2024 sono stati riportati i risultati di efficacia relativi alla seconda analisi ad interim prespecificata (data cut-off: 11 gennaio 2023).
METODI
In questo studio randomizzato di fase 3, open-label, sono stati coinvolti pazienti (donne e uomini) con carcinoma mammario HR+/HER2-negativo Stadio II o Stadio III.
I pazienti sono stati randomizzati (1:1) a ricevere ribociclib x 3 anni + endocrinoterapia (braccio sperimentale) oppure sola endocrinoterapia (braccio standard) (Figura 1).
Il trattamento con ribociclib era previsto per 3 anni, al dosaggio di 400 mg/os/die (dosaggio inferiore a quello utilizzato negli studi clinici effettuati nel setting metastatico) (Figura1).
Il trattamento con inibitori dell’aromatasi non steroidei era previsto per 5 anni: un addizionale trattamento con NSAI oltre i 5 anni era a discrezione dell’investigatore e non è stato considerato come parte del trattamento dello studio.
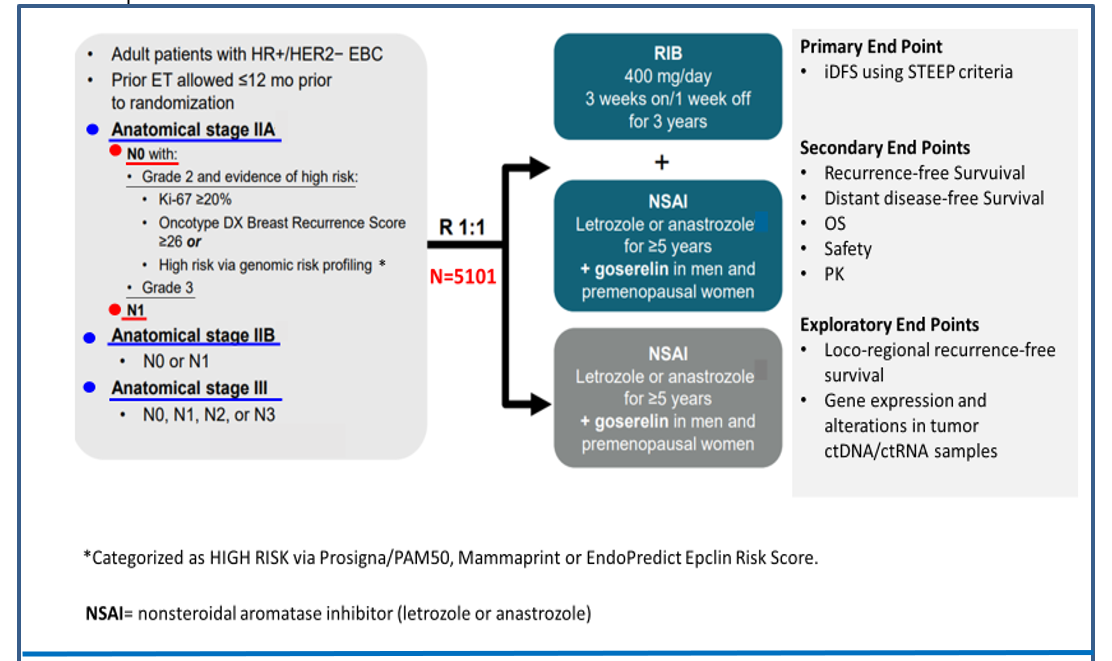

I pazienti non erano elegibili se avevano ricevuto precedente trattamento con inibitori di CDK 4/6 o se avevano una malattia cardiaca clinicamente significativa e non controllata, anomalie della ripolarizzazione cardiaca o entrambe.
La randomizzazione è stata stratificata in accordo a:
- Stadio anatomico: stadio II vs stadio III
- Stato menopausale: donne in premenopausa e uomini vs donne in post-menopausa
- Precedente chemioterapia adiuvante o neoadiuvante: SI vs NO
- Sede geografica: Nord America/Europa Occidentale/Oceania vs resto del mondo.
L’end point primario dello studio era l’invasive-Disease Free Survival (iDFS) definita secondo i criteri STEPP v.1 (Hudis CA, JCO 2007).
Erano end point secondari:
- Sopravvivenza libera da malattia a distanza (Distant Disease-Free Survival=DDFS)
- Sopravvivenza Globale (Overall Survival=OS)
- Sopravvivenza libera da ripresa (Recurrence-Free Survival=RFS)
- Safety
- Quality of Life
- Farmacocinetica.
In questo articolo sono stati riportati i risultati della seconda interim analisi pre-specificata (data cut-off: 11 gennaio 2023), effettuata dopo che si erano verificati 426 eventi per la iDFS.
Le analisi di efficacia sono state effettuate nella “ intent-to-treat” (ITT) population, che includeva tutti i pazienti randomizzati.
RISULTATI
Da gennaio 2019 a aprile 2021 sono stati randomizzati 5.101 pazienti a ricevere ribociclib + endocrinoterapia (N=2549) oppure solo endocrinoterapia (N=2552).
L’età mediana dei pazienti era 52 anni (range 24-90); il 55,7% erano in postmenopausa e lo 0,4% erano uomini. I pazienti avevano un carcinoma mammario Stadio IIA nel 19,6% dei casi, Stadio IIB nel 20,5%, Stadio III nel 59,6%. Erano N0 patologici il 15,6%, N1 il 41,2%, N2 o N3 il 43%; erano G2-G3 nel 78% dei casi. L’88% dei pazienti aveva ricevuto chemioterapia (adiuvante=42,7% o neoadiuvante= 47,9%).
Il 73% dei casi erano carcinomi duttale invasivi e il 18% carcinomi lobulari invasivi.
Al momento di questa analisi, il 20,2% (N=515) dei pazienti aveva completato i tre anni di ribociclib e 1147 (45%) stavano continuando a ricevere ribociclib.
La durata mediana del follow up era di 34 mesi (dalla data della randomizzazione al data cut-off: 11 gennaio 2023).
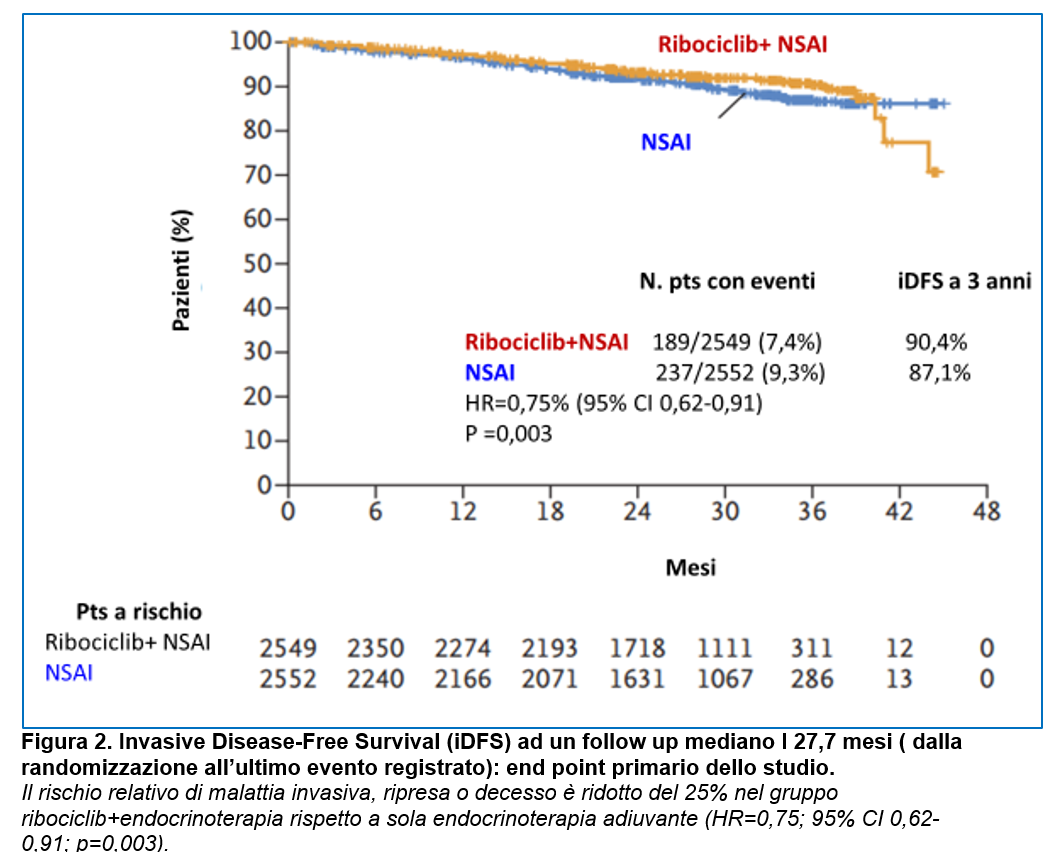
L’analisi della iDFS (eseguita dopo che 426 pazienti avevano presentato uno dei seguenti eventi per la iDFS: ripresa invasiva mammaria omolaterale o locoregionale, carcinoma invasivo mammario controlaterale, metastasi a distanza, secondo tumore invasivo non mammario) ha evidenziato una iDFS a 3 anni del 90,4% con ribociclib vs 87,1% con sola endocrinoterapia, con HR=0,75, 95% CI 0,62-0,91 e un valore di p=0,003 che incontra il limite di significatività prefissato a 0,0256 (Figura 2).
Le riprese a distanza sono stati gli eventi più frequenti: 120 (4,7%) nel gruppo ribociclib + NSAI vs 170 (6,7%) nel gruppo sola endocrinoterapia. Le sedi di ripresa a distanza più frequenti sono state l’osso e il fegato in entrambi i gruppi.
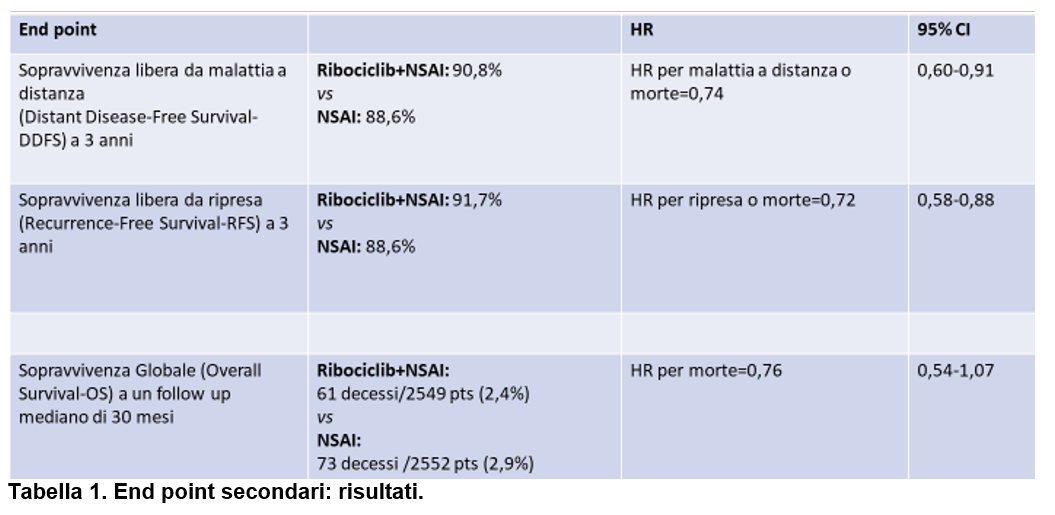
I risultati degli end point secondari sono riportati nella Tabella 1.
SAFETY
Non sono stati segnalati effetti collaterali nuovi. Gli eventi avversi più comuni (di qualsiasi grado) sono stati la neutropenia (62,1% nel gruppo ribociclib vs 4,5% nel gruppo solo endocrinoterapia), artalgia (36,5% nel gruppo ribociclib vs 42,5% nel gruppo endocrinoterapia) e epatotossicità (25,4% vs 10,4%).
Neutropenia e aumento delle transaminasi sono anche stati gli eventi più frequenti di grado ≥3-4 osservati nel gruppo di pazienti trattati con ribociclib +endocrinoterapia.
Un prolungamento dell’intervallo QT (di qualsiasi grado) è stato osservato nel 5,2% dei pazienti del gruppo ribociclib+endocrinoterapia vs 1,2% dei pazienti del gruppo sola endocrinoterapia.
Gli eventi avversi hanno determinato una interruzione precoce di ribociclib nel 18,9% dei pazienti.
Nessun decesso (60 nel gruppo ribociclib e 74 nel gruppo sola endocrinoterapia) è stato correlato al trattamento.

RISULTATI dell’ANALISI ESPLORATORIA a 4 anni.
L’iDFS a 4 anni è risultata essere statisticamente più lunga nei pazienti del gruppo ribociclib (Figura 3) con una differenza in termini assoluti del 4,9% e che aumenta anche dopo la sospensione del ribociclib.
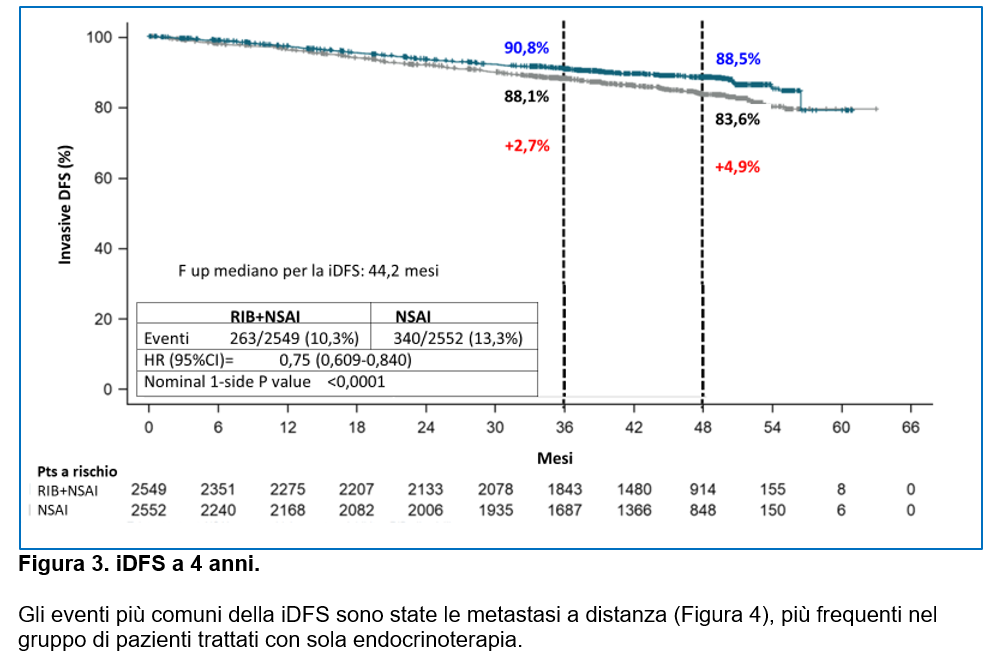
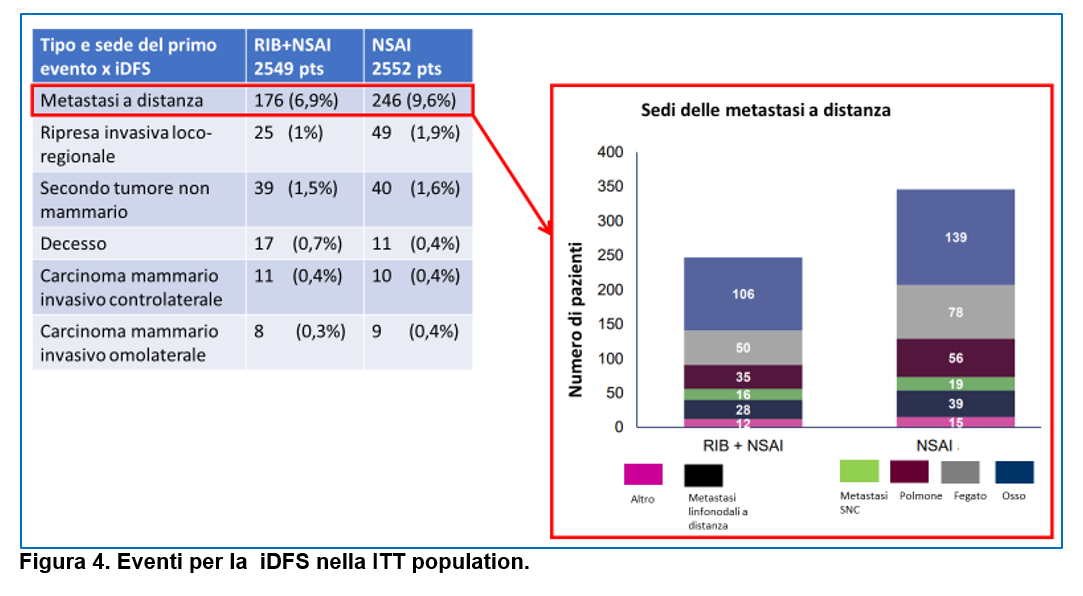
All’analisi dei sottogruppi prespecificati, l’associazione ribociclib+NSAI ha evidenziato un vantaggio in iDFS :
–sia nel sottogruppo di pazienti STADIO II ( differenza in iDFS a 4 anni: 4,3%) ( Figura 5A) che nel sottogruppo di pazienti STADIO III (differenza in termini assoluti in iDFS a 4 anni: 5,9%) ( Figura 5B);
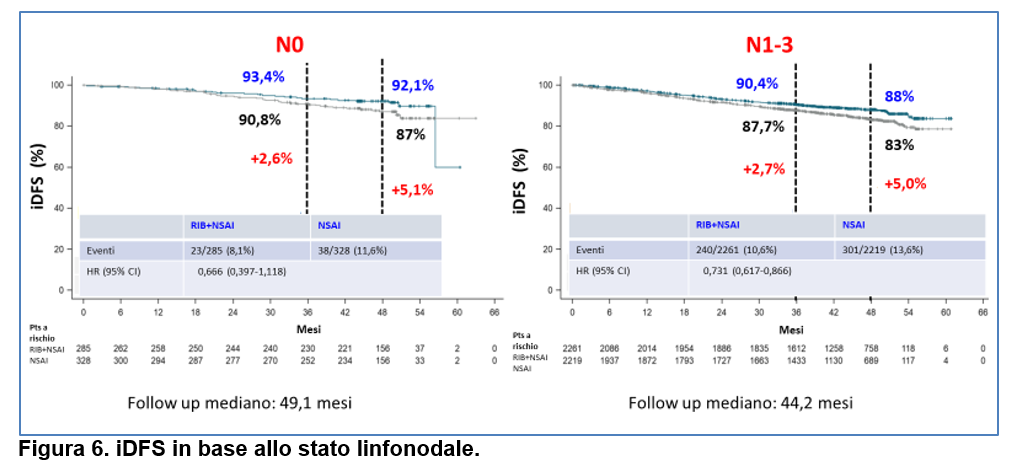
–sia nel sottogruppo N0 (differenza in termini assoluti in iDFS a 4 anni: 5,1%) che nel sottogruppo N1-3 (differenza in termini assoluti in iDFS a 4 anni: 5%) ( Figura 6).
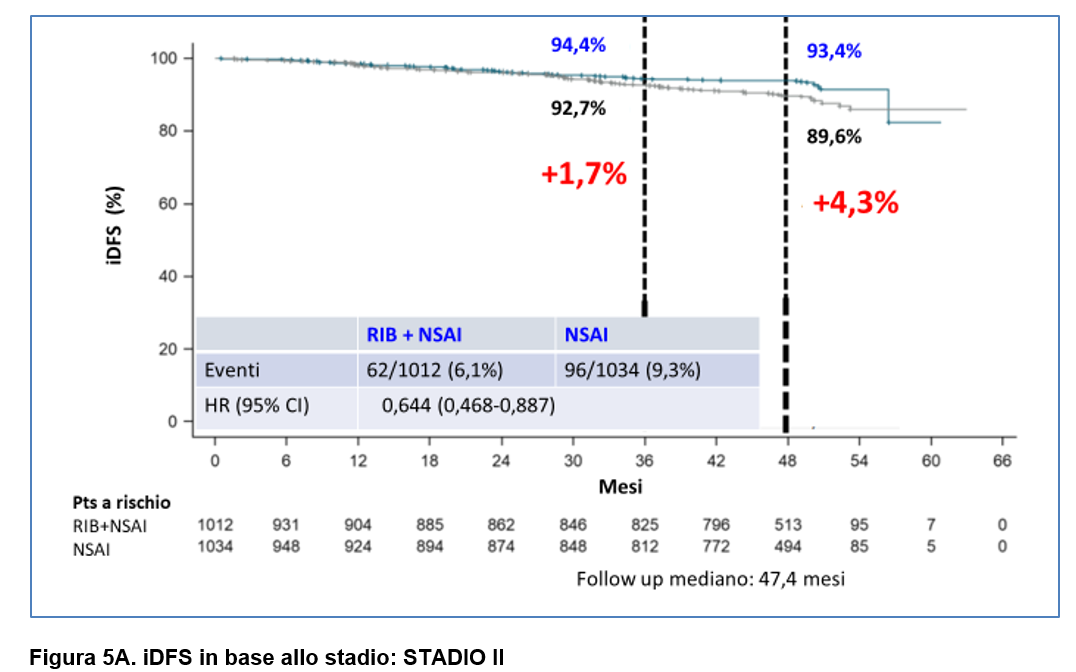
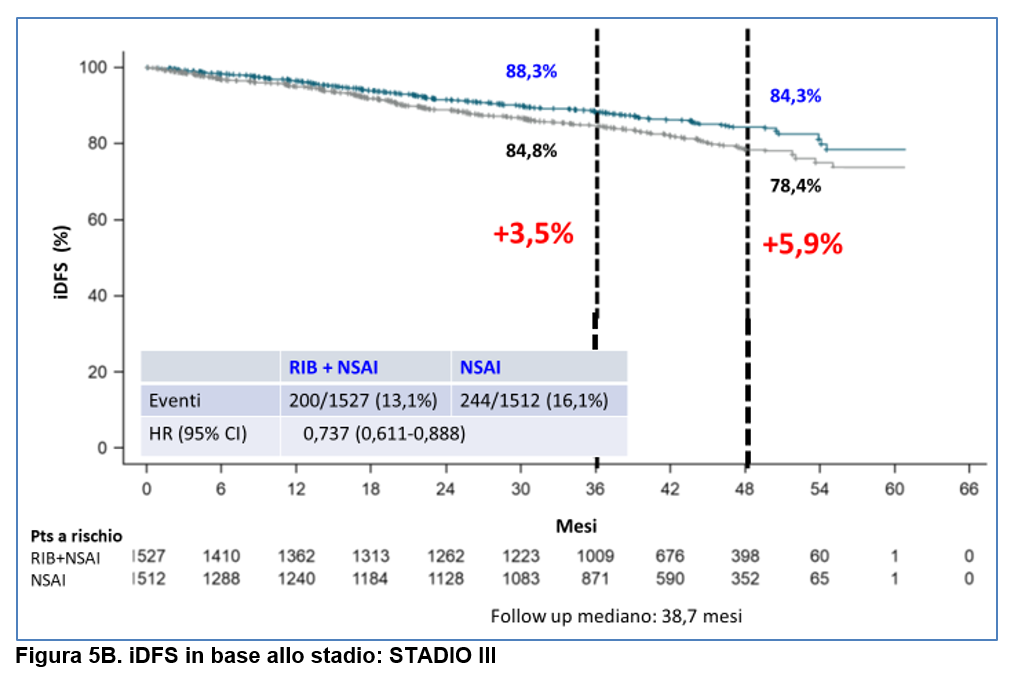
Per quanto riguarda la safety, a questo follow up addizionale, sono rimasti pressochè stabili i tassi di interruzione di ribociclib dovuti a eventi avversi (20%).
Gli effetti collaterali di grado 3-4 più frequenti nel gruppo di pazienti trattati con ribociclib+NSAI sono stati la neutropenia (44,4% vs 0,9%) e l’aumento delle transaminasi ((18,6% vs 1,7%) senza concomitante aumento della bilirubina.
Ad un follow up addizionale, i risultati dello studio NATALEE continuano ad evidenziare un beneficio derivante dalla combinazione ribociclib+NSAI nella popolazione con carcinoma mammario HR+/HER2-negativo in fase precoce a rischio di ripresa di malattia, anche dopo i 3 anni di terapia con ribociclib.

Bibliografia
PAN H et al. EBCTCG. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017;377(19):1836-1846.
Slamon DJ et al. Rationale and trial design of NATALEE: a phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2L early breast cancer.
Ther Adv Med Oncol 2023; 15:1-16
Hudis Ca eta l. Proposal for Standardized definitions for efficacy end points in adjuvant breast cancer trials: the STEEP system. J Clin Oncol 2007; 25;2127-2132.
Hortobagyi G, et al. Ribociclib (RIB) + nonsteroidal aromatase inhibitor (NSAI) as adjuvant treatment in patients with HR+/HER2− early breast cancer: final invasive disease–free survival (iDFS) analysis from the NATALEE trial. Presented at: 2023 San Antonio Breast Cancer Symposium. December 5-9, 2023; Abstract GS03-03
Flasching PA et al. Adjuvant ribociclib (RIB) plus nonsteroidal aromatase inhibitor (NSAI) in patients (Pts) with HR+/HER2L early breast cancer (EBC): 4-year outcomes from the NATALEE trial.
Ann Oncol 2024; 35 (S2):1207 #LBA13.


