
HORMONAL CONTRACEPTION AND BREAST CANCER RISK FOR CARRIERS OF GERMLINE MUTATIONS IN BRCA1 AND BRCA2
Phillips KA, Kotsopoulos J, Domchek SM, Terry MB, Chamberlain JA, Bassett JK, Aeilts AM, Andrulis IL, Buys SS, Cui W, Daly MB, Eisen AF, Foulkes WD, Friedlander ML, Gronwald J, Hopper JL, John EM, Karlan BY, Kim RH, Kurian AW, Lubinski J, Metcalfe K, Nathanson KL, Singer CF, Southey MC, Symecko H, Tung N, Narod SA, Milne RL; Kathleen Cuningham Foundation Consortium for Research Into Familial Breast Cancer, the Risk Factor Analysis of Hereditary Breast and Ovarian Cancer Study, the Basser Center University of Pennsylvania Registry, and the Breast Cancer Family Registry; Kathleen Cuningham Foundation Consortium for Research Into Familial Breast Cancer, the Risk Factor Analysis of Hereditary Breast and Ovarian Cancer Study, the Basser Center University of Pennsylvania Registry and the Breast Cancer Family Registry.
J Clin Oncol. 2024 Oct 2:JCO2400176. doi: 10.1200/JCO.24.00176.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/39356978/
Le donne portatrici di mutazioni germinali dei geni BRCA1 o BRCA2 hanno un rischio elevato di sviluppare durante la loro vita un carcinoma mammario, pari a circa il 70%, ed oltre la metà di queste neoplasie mammarie si verificano prima dei 50 anni d’età. È importante quindi comprendere se e come l’utilizzo di una contraccezione ormonale possa influenzare questo rischio.
La contraccezione orale comprende pillole orali contraccettive, impianti ormonali, iniezioni, devices intrauterini (IUD): questi hanno una eccellente efficacia contraccettiva e le pillole orali contraccettive possono essere utili anche nel trattamento della sindrome ovarica policistica, nel disordine disforico premestruale, nelle endometriosi e riducono il rischio di cancro ovarico e di cancro dell’endometrio. Nella popolazione generale, l’uso in corso di contraccezione orale è associato ad un aumento relativo del 20%-30% del rischio di carcinoma mammario rispetto a chi non ha mai usato tale contraccezione, con un rischio aumentato nel caso di una più lunga durata di tale uso, e, sebbene il rischio relativo si riduca dopo la cessazione, rimane elevato per 5-10 anni dopo l’interruzione della contraccezione orale. La maggior parte dei dati pubblicati è riferita solo a varie formulazioni di pillole contraccettive orali, ma l’associazione è simile per i contraccettivi basati sul solo progesterone.
Gli studi di associazione tra uso di pillole contraccettive orale e rischio di carcinoma mammario per le portatrici sane di mutazioni BRCA1 e BRCA2 hanno una casistica limitata, sono caso-controllo e hanno fornito dati discordanti. Inoltre non sono disponibili dati relativi al rischio di carcinoma mammario associato con l’uso di altri tipi di contraccezione orale, come impianti ormonali e IUD per le portatrici di mutazioni BRCA1 e BRCA2.
In questo studio è stato valutata l’associazione tra uso di qualsiasi contraccezione ormonale e rischio di carcinoma mammario per donne portatrici di mutazioni BRCA1 e BRCA2 utilizzando dati individuali dei partecipanti a 4 studi prospettici di coorte.
METODI
Sono state incluse in questo studio osservazionale i dati di donne con mutazione BRCA1 e BRCA2 arruolate tra dicembre 1991 e agosto 2010 in 4 studi di coorte (kConFab FUP, BCFR, RFS, UPenn Registry).
Le partecipanti incluse in questa analisi dovevano avere informazioni disponibili sul loro follow up avere almeno 18 anni essere nate dopo il 1920, non avere all’anamnesi un precedente cancro (ad eccezione del carcinoma della cervice in sito o un tumore della cute non melanoma) né una mastectomia bilaterale profilattica al momento dell’arruolamento nello studio di coorte.
I dati sono stati raccolti e aggiornati tramite questionari auto-riportati somministrati alle donne annualmente o ogni 2 o 3 anni in base coorte prospettica. La diagnosi di carcinoma è stata confermata da referti di anatomia patologica.
Per quanto riguarda il tipo di terapia ormonale anti-concezionale (HC), le 4 coorti hanno incluso tipologie differenti:
- RFS e kConFab: tutti i tipi di HC (pillola orale anti-concezionale, impianti ormonali, iniezioni, dispositivi intrauterini);
- BCFR: pillola anti-concezionale (inclusa quella composta da soli progestinico), impianti ormonali, iniezioni e sono stati esclusi i dispositivi intrauterini;
- UPenn Registry: pillola combinata anti-concezionale e quella solo progestinica e sono stati esclusi altri tipi di anti-concezionali ormonali.
RISULTATI
Su un totale di 48.822 donne arruolate nei quattro studi di coorte, 5.391 donne sono state incluse nelle analisi finali.
Tra le 3.882 donne portatrici di mutazioni BRCA1 e le 1.509 portatrici di mutazioni BRCA2, rispettivamente il 53% e il 71% avevano fatto uso di HC per almeno 1 anno. La durata mediana cumulativa dell’uso di HC è stata di 4,8 anni per le portatrici di BRCA1 e di 5,7 anni per le portatrici di BRCA2.
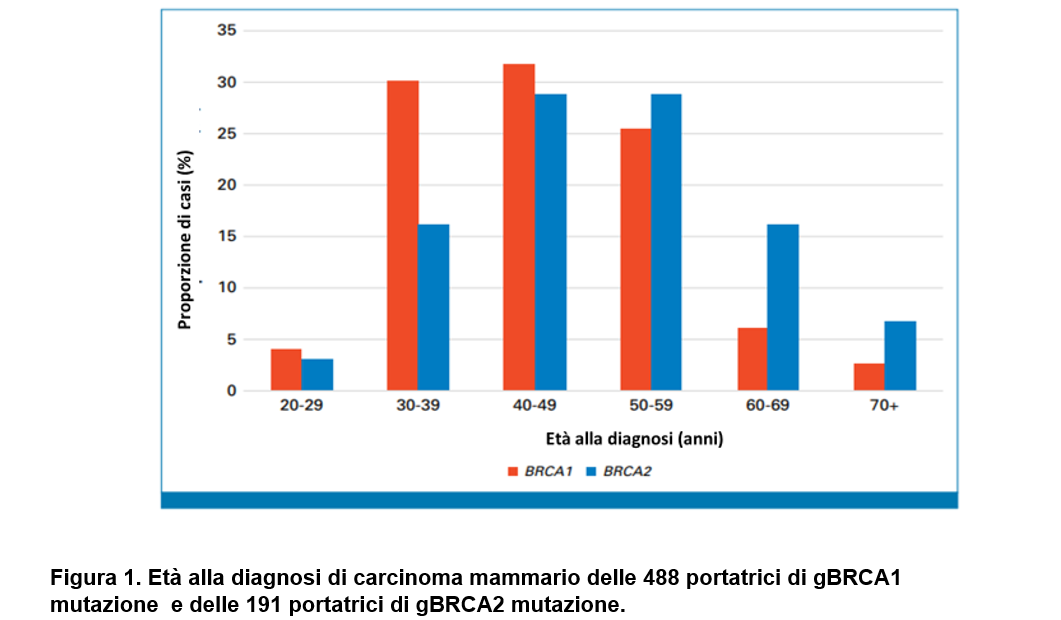
Durante un periodo mediano di follow-up di 5,9 anni per le portatrici di BRCA1 e di 5,6 anni per le portatrici di BRCA2, è stato diagnosticato un carcinoma mammario incidente in 488 portatrici di BRCA1 (di cui 440 casi invasivi) e in 191 portatrici di BRCA2 (di cui 151 casi invasivi).
BRCA1
Sono state incluse 3.882 donne portatrici di mutazione BRCA1. Gli hazard ratio stimati (HR) indicano un rischio elevato di carcinoma mammario associato sia all’uso attuale che passato di contraccettivi ormonali (HC) rispetto al non utilizzo da parte delle portatrici di mutazione BRCA1, anche se nessuno di questi risultati è risultato statisticamente significativo:
- HR 1,40 (IC 95%, 0,94-2,08), P= 0,10 per l’uso attuale entro 1 anno;
- HR 1,16 (IC 95%, 0,80-1,69), P= 0,4 per l’uso da 1 a 5 anni prima;
- HR 1,40 (IC 95%, 0,99-1,97), P= 0,05 per l’uso da 6 a 10 anni prima;
- HR 1,27 (IC 95%, 0,98-1,63), P= 0,07 per l’uso >10 anni prima.
Quando l’uso è stato valutato come variabile binaria, l’uso continuo è stato associato ad un aumento di carcinoma mammario (HR 1,29 [IC 95%, 1,04-1,60], P = 0,02).
Dopo aggiustamento per l’uso attuale e passato, non sono state rilevate associazioni significative tra:
- Età più giovane all’inizio della HC (HR per anno: 1,01 [IC 95%, 0,99-1,04], P= 0,4);
- Uso di HC prima della prima gravidanza a termine (HR 1,23 [IC 95%, 0,89-1,70], P= 0,2).
Tuttavia, la durata cumulativa dell’uso di HC è risultata associata a un aumento del rischio di carcinoma mammario (HR per anno di utilizzo: 1,03 [IC 95%, 1,00-1,06], P = 0,03). Inoltre, quando la durata cumulativa è stata inclusa nel modello, non è emersa alcuna evidenza di variazione del rischio in base alla recente cessazione dell’uso:
- HR 1,08 (IC 95%, 0,67-1,72), P= 0,8 per l’uso attuale;
- HR 0,92 (IC 95%, 0,60-1,41), P= 0,7 per l’uso da 1 a 5 anni prima;
- HR 1,16 (IC 95%, 0,78-1,71), P= 0,5 per l’uso da 6 a 10 anni prima;
- HR 1,14 (IC 95%, 0,87-1,50), P= 0,3 per l’uso >10 anni prima.
Il modello basato sulla durata cumulativa dell’uso, senza includere l’uso attuale o passato, ha mostrato il miglior adattamento e ha fornito la stessa stima dell’HR con maggiore precisione (HR per anno di uso = 1,03 [IC 95%, 1,01-1,05], P = 0,002).
Gli HR stimati per categorie di durata cumulativa sono stati coerenti con una risposta lineare alla dose:
- HR 1,13 (IC 95%, 0,88-1,45), P= 0,3 per 1-5 anni di uso;
- HR 1,47 (IC 95%, 1,11-1,96), P= 0,007 per 6-10 anni di uso;
- HR 1,56 (IC 95%, 1,13-2,17), P= 0,007 per >10 anni di uso.
Non ci sono dati relativi a durata della terapia ormonale anti-concezionale superiore a 15 anni.
I risultati per BRCA1 sono stati coerenti nelle analisi di sensibilità e stratificate per coorte e paese, in particolare per quanto riguarda la durata cumulativa dell’uso. L’HR stimato per ogni anno aggiuntivo di uso di HC è stato compreso tra 1,03 e 1,05 per ciascuna coorte e paese. Quando l’osservazione è stata censurata alla menopausa (escludendo quindi qualsiasi potenziale influenza della terapia ormonale sostitutiva), l’HR è risultato pari a 1,04 (IC 95%, 1,01-1,07, P = 0,02).
BRCA2
Sono state incluse 1.509 donne portatrici di mutazione BRCA2. Non è stata riscontrata un’associazione significativa tra l’uso (attuale e passato) di contraccettivi ormonali (HC) e il rischio di carcinoma mammario (BC) per le portatrici di mutazione BRCA2:
- Uso attuale di HC: HR 0,70 (IC 95%, 0,33-1,47), P= 0,3;
- Uso passato:
- 1-5 anni prima: HR 0,80 (IC 95%, 0,40-1,61), P= 0,5;
- 6-10 anni prima: HR 1,08 (IC 95%, 0,57-2,05), P= 0,8;
- 10 anni prima: HR 1,15 (IC 95%, 0,77-1,70), P= 0,5.
Non è emersa alcuna evidenza di associazione con:
- L’uso continuo: HR 1,07 (IC 95%, 0,73-1,57), P= 0,7;
- Durata cumulativa dell’uso: HR per anno di uso = 0,99 (IC 95%, 0,96-1,03), P= 0,6;
- Età più giovane all’inizio della HC: HR per anno = 0,99 (IC 95%, 0,95-1,03), P= 0,5;
- Uso di HC prima della prima gravidanza a termine: HR 1,16 (IC 95%, 0,64-2,12), P= 0,6.
Assumendo che un rischio in eccesso legato all’uso attuale di HC diminuisca fino a zero entro 10 anni dalla cessazione, l’HR stimato per l’uso attuale (HR 0,66 [IC 95%, 0,38-1,14]) è risultato significativamente inferiore rispetto all’HR stimato di 1,24 riportato dal gruppo di Oxford per la popolazione generale (P = 0,02).
CONCLUSIONI
I risultati di questo studio suggeriscono che l’uso di contraccettivi ormonali aumenta il rischio di carcinoma mammario per le portatrici sane di mutazione BRCA1. L’uso di contraccettivi ormonali per almeno un periodo continuo di 12 mesi è stato associato a un aumento medio del rischio relativo di carcinoma mammario del 29% rispetto a chi non li ha mai utilizzati. Tuttavia, questo aumento del rischio variava in base alla durata cumulativa, con un incremento proporzionale del 3% per ogni anno di utilizzo. Non è stata osservata alcuna associazione significativa tra il rischio di BC e un’età precoce al primo uso o l’uso antecedente alla prima gravidanza.
Al contrario, non è stato evidenziato un aumento del rischio di BC associato all’uso di HC nelle portatrici di mutazione BRCA2. Tuttavia, l’analisi per BRCA2 si basa su un numero limitato di casi di BC (191), e gli intervalli di confidenza erano ampi, suggerendo che ulteriori studi potrebbero essere necessari per confermare o escludere un’associazione.
Integrare questi risultati in modelli di previsione del rischio, come CanRisk, potrebbe offrire stime personalizzate e più precise. Questi strumenti potrebbero essere fondamentali per supportare decisioni informate e strategie di prevenzione individualizzate.
Le portatrici di mutazioni BRCA1 e BRCA2 hanno un rischio molto elevato di sviluppare un tumore tubo-ovarico nel corso della vita, con un aumento del rischio rispetto alla popolazione generale a partire, rispettivamente, dalla fine dei 30 anni e dalla metà dei 40 anni. Le linee guida raccomandano una salpingo-ooforectomia bilaterale entro i 35-40 anni e i 40-45 anni, rispettivamente, che elimina questo rischio. Pertanto, sebbene i contraccettivi orali combinati riducano sostanzialmente il rischio di tumore tubo-ovarico, questo beneficio diventa eccessivo quando si seguono le linee guida sulla salpingo-ooforectomia bilaterale.
I principali punti di forza di questo studio includono l’ampio campione di portatori di mutazione BRCA1, il disegno prospettico (l’uso di contraccettivi ormonali è stato riportato prima della diagnosi di tumore), la raccolta sistematica dei dati e l’uso di tecniche di imputazione multipla per affrontare i dati mancanti. La coerenza delle stime di rischio relativo (HR) per la durata cumulativa dell’uso di contraccettivi ormonali nei portatori di mutazione BRCA1 tra diverse coorti e paesi supporta la generalizzabilità di questo risultato. Tuttavia, la limitazione più importante dello studio è il suo disegno osservazionale, che potrebbe aver introdotto bias rilevanti. Poche donne nello studio hanno usato contraccettivi ormonali per più di 15 anni; pertanto, i risultati non dovrebbero essere estesi oltre questo periodo. Un’altra limitazione è che la completezza dei dati sul tipo di contraccettivo ormonale variava tra gli studi; di conseguenza, alcune partecipanti che hanno utilizzato contraccettivi diversi dai contraccettivi orali combinati potrebbero essere state erroneamente classificate come non utilizzatrici o aver sottostimato la durata dell’uso, il che potrebbe aver portato a risultati nulli. I contraccettivi orali combinati hanno probabilmente influenzato i risultati dello studio, essendo il contraccettivo più comunemente usato. Emergono evidenze di possibili differenze nel rischio di tumore al seno associate a diverse formulazioni di contraccettivi orali combinati, in particolare per quanto riguarda il tipo di progestinico. Non erano disponibili i dati sulla formulazione dei contraccettivi orali combinati usati e si dovrebbe tenere in considerazione la variazione delle formulazioni nel tempo, notando che le formulazioni più vecchie avevano generalmente dosi più elevate di estrogeni rispetto a quelle più recenti.
Il riscontro di un aumento del rischio di tumore al seno con l’aumentare della durata dell’uso di contraccettivi ormonali nelle portatrici di mutazione BRCA1 è interessante, considerando che il tumore al seno in queste donne è spesso di fenotipo triplo negativo. Tuttavia, ciò è coerente con una recente meta-analisi sui fattori di rischio per il tumore al seno triplo negativo. Quell’analisi ha rilevato che, sebbene l’uso dei COC non fosse statisticamente associato a un aumento del rischio di tumore al seno triplo negativo, l’uso per 10 anni o più era associato a un aumento relativo del rischio di circa il 30%. Lo stato di mutazione BRCA1 dei partecipanti negli studi meta-analizzati non era noto.
Due recenti meta-analisi hanno mostrato un aumento del rischio di tumore al seno per le donne con mutazioni BRCA1 e BRCA2 che hanno utilizzato COC. Park et al. hanno stimato un rischio relativo di 1,24 [95% CI, 1,08-1,41], con risultati simili per i portatori di mutazione BRCA1 e BRCA2 analizzati separatamente. Le associazioni statisticamente significative sono state osservate solo per un uso superiore a 5 anni. Van Bommel et al. hanno mostrato un’associazione tra l’uso di contraccettivi ormonali e un aumento del rischio di tumore al seno per portatori di mutazioni BRCA1 e BRCA2 negli studi di coorte (HR, 1,55 [95% CI, 1,36-1,76]). Anche un uso precedente a più di 10 anni era associato a un aumento del rischio (HR, 1,40 [95% CI, 1,13-1,73]).
L’uso di contraccettivi ormonali aumenta il rischio di tumore al seno nella popolazione generale. L’Oxford Collaborative Group ha analizzato dati epidemiologici di 153.536 donne, mostrando un aumento del rischio di tumore al seno durante l’uso dei contraccettivi orali combinati (rischio relativo [RR], 1,24 [95% CI, 1,15-1,33]), che si riduce gradualmente nei 10 anni successivi alla cessazione. Dopo aver considerato la recente interruzione, la durata dell’uso, l’età al primo utilizzo e se l’uso dei contraccettivi orali combinati fosse iniziato prima o dopo la prima gravidanza hanno avuto un impatto minimo sulle stime. Lo studio Nurses’ Health Study, condotto su 116.429 donne, ha rilevato che le utenti attuali dei contraccettivi orali combinati avevano un rischio relativo di tumore al seno di 1,31 (95% CI, 1,09-1,58) rispetto alle non utilizzatrici, e il rischio diminuiva con il tempo dalla cessazione. Uno studio basato sui dati del registro nazionale danese su 1,8 milioni di donne ha riportato risultati simili per tutti i tipi di contraccettivi ormonali contemporanei, incluso il dispositivo intrauterino ormonale. Il rischio relativo stimato era di 1,20 (95% CI, 1,14-1,26) per le utenti attuali e recenti rispetto alle non utilizzatrici, con un rischio crescente con la durata dell’uso (RR, 1,38 [95% CI, 1,26-1,51] per più di 10 anni di uso rispetto a non utilizzo) e che rimaneva elevato per più di 5 anni dopo la cessazione. Vi erano alcune evidenze che l’inizio dell’uso a un’età più giovane fosse associato a un aumento del rischio di tumore al seno.
I risultati di questo studio sono coerenti con un’associazione tra l’uso di contraccettivi ormonali e un aumento simile del rischio relativo di tumore al seno nei portatori di mutazione BRCA1, come osservato nella popolazione generale. Inoltre, è stato osservato l’evidenza di una relazione tra l’aumento del rischio di tumore al seno e l’aumento della durata dell’uso.
Dato il numero relativamente piccolo di eventi e le evidenze inconsistenti provenienti da altri studi, i risultati per i portatori di mutazione BRCA2 dovrebbero essere interpretati con cautela e non dovrebbero essere utilizzati per consigliare alle donne che l’uso di contraccettivi ormonali non aumenta il rischio di tumore al seno.
Bibliografia
Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Lancet. 1996 Jun 22;347(9017):1713-27. doi: 10.1016/s0140-6736(96)90806-5. PMID: 8656904.
Kumar N, Ehsan S, Banerjee S, Fernandez Perez C, Lhuilier I, Neuner J, Friebel-Klingner T, Fayanju OM, Nair B, Niinuma SA, Nampoothiri S, McCarthy AM. The unique risk factor profile of triple-negative breast cancer: a comprehensive meta-analysis. J Natl Cancer Inst. 2024 Aug 1;116(8):1210-1219. doi: 10.1093/jnci/djae056. PMID: 38445713; PMCID: PMC11308168.
Park J, Huang D, Chang YJ, Lim MC, Myung SK. Oral contraceptives and risk of breast cancer and ovarian cancer in women with a BRCA1 or BRCA2 mutation: a meta-analysis of observational studies. Carcinogenesis. 2022 Apr 25;43(3):231-242. doi: 10.1093/carcin/bgab107. PMID: 34958358.
van Bommel MHD, IntHout J, Veldmate G, Kets CM, de Hullu JA, van Altena AM, Harmsen MG. Contraceptives and cancer risks in BRCA1/2 pathogenic variant carriers: a systematic review and meta-analysis. Hum Reprod Update. 2023 Mar 1;29(2):197-217. doi: 10.1093/humupd/dmac038. PMID: 36383189; PMCID: PMC9976973.
Commento a cura di Giulia Borghesani- Oncologia Medica- IRCCS Sacro Cuore Don Calabria, Negrar di Valpolicella (VR)
L’uso di anti-concezionali ormonali nella portatrici di mutazione di BRCA1 e BRCA2 rimane un argomento di discussione in quanto aumenta il rischio di sviluppare tumore al seno in una popolazione già predisposta dal un punto di vista genetico.
La qualità delle prove a disposizione dei clinici si basa soprattutto su revisione sistematiche e meta-analisi (quelle già citate di Park J et al. e Van Bommel et al.), e su studi di coorte retrospettivi. Questa analisi rappresenta un’ulteriore conferma di quanto osservato in modo retrospettivo e aumenta la qualità delle prove a disposizione della comunità scientifica.
La caratteristica più rilevante dello studio è la numerosità del campione 5391 (3.882 donne portatrici di mutazioni BRCA1 e le 1.509 donne portatrici di mutazioni BRCA2) e le 4 coorti coinvolte hanno arruolato donne da diversi Paesi (Australia, Nuova Zelanda, Europa, Canada, e Stati Uniti), quindi una popolazione eterogenea da un punto di vista geografico. L’altra caratteristica è che la raccolta dei dati riguardava donne sane portatrici di mutazione BRCA1 e BRCA2 in assenza di diagnosi di tumore al seno e/o ovaio. Le informazioni sono state raccolte in modo sistematico tramite questionari o follow-up regolari, e aggiornate periodicamente anche in base alle nuove diagnosi di malattia tumorale confermate da referti di anatomia patologica.
Dai risultati emersi, le donne portatrici di mutazione di BRCA1 hanno un rischio maggiore sia dall’utilizzo attuale che quello passato di anti-concezionali orali, di un aumento del rischio di sviluppare un tumore al seno. Inoltre il rischio aumenta per ogni anni di utilizzo e rimane superiore alla popolazione che non fa uso di HC anche dopo la cessazione.
Invece per le donne potatrici di mutazione di BRCA2 non si è confermato lo stesso trend, sottolineando che la numerosità del campione e il numero di eventi erano troppo limitati.
In questa analisi, è stato valutato non solo il rischio relativo ma anche quello assoluto in base ad età e stato menopausale di sviluppare un tumore al seno. Tale rischio potrebbe essere inserito in algoritmi decisionali e fornire strumenti più precisi per consigliare le donne in merito all’utilizzo o meno di anti-concezionali ormonali e soprattutto per quanto tempo. La decisione sull’uso di HC nelle donne con un rischio aumentato di tumore al seno a causa di mutazioni BRCA1 deve bilanciare attentamente i rischi e i benefici assoluti; mentre un uso a breve termine potrebbe comportare solo piccoli aumenti, un uso prolungato cumulativo potrebbe determinare aumenti maggiori del rischio assoluto di tumore al seno, non accettabili per alcune donne.


