
UGT1A1*28 POLYMORPHISM AND THE RISK OF TOXICITY AND DISEASE PROGRESSION IN PATIENTS WITH BREAST CANCER RECEIVING SACITUZUMAB GOVITECAN.
Wong MH, Jones VC, Yu W, Bosserman LD, Lavasani SM, Patel N, Sedrak MS, Stewart DB, Waisman JR, Yuan Y, Mortimer JE.
Cancer Med. 2024 Aug;13(16):e70096. doi: 10.1002/cam4.70096.
LINK all’abstract: https://pubmed.ncbi.nlm.nih.gov/39157928/
LINK all’articolo (FREE): https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11331244/pdf/CAM4-13-e70096.pdf
SACITUZUMAB GOVITECAN è un anticorpo farmaco-coniugato (ACD), diventato una opzione terapeutica importante in carcinoma mammario avanzato HER2-negativo.
Sacituzumab govitecan è un anticorpo farmaco-coniugato (antibody-drug conjugate, ADC) diretto contro l’antigene di superficie TROP-2 (Trophoblast cell surface antigen 2), una proteina sovraespressa nell’88% delle cellule del carcinoma mammario triplo negativo, ma anche in molti altri tumori. Il recettore Trop-2 stimola la crescita, la proliferazione delle cellule e la metastatizzazione.
Sacituzumab govitecan è costituito da un anticorpo anticorpo monoclonale umanizzato (hRS7 IgG1κ) e da un farmaco chemioterapico (payload) detto SN-38 (7-etil-10-idrossi-camptotecina), che rappresenta il metabolita attivo dell’irinotecano (un farmaco antineoplastico facente parte della classe della camptotecine, inibitori della topoisomerasi I) ed è circa 200 volte più attivo rispetto all’irinotecano stesso. L’anticorpo è legato ad SN-38 con legame covalente idrolizzabile. A ogni molecola di anticorpo sono legate approssimativamente 7-8 molecole di SN-38 (Figura 1).
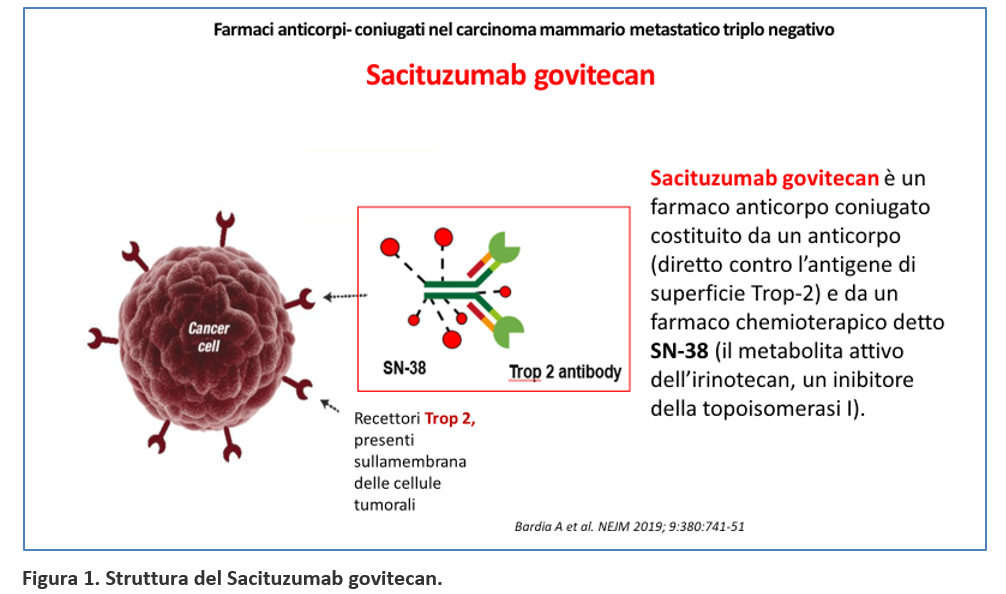
Il sacituzumab govitecan agisce legandosi al recettore TROP-2 presente sulla superficie della cellula tumorale e liberando il farmaco antitumorale SN-38 che agisce sia sulle cellule tumorali bersaglio ma anche, avendo la caratteristica di attraversare le membrane cellulari, sulle cellule tumorali adiacenti.
Il farmaco antitumorale SN-38 è poi degradato all’enzima Uridina-Difosfato Gluceronosiltransferasi codificata dal gene UGT1A1.
Poichè è stato dimostrato che i polimorfismi UGT1A1 sono associati ad una ridotto metabolismo dell’SN-38, con aumentata tossicità ( neutropenia e diarrea) (TAKANO M, 2017), in questo studio retrospettivo è stato valutato se i polimorfismi di UGT1A1 sono associati con minor interruzioni dalla terapia per progressione di malattia e con aumentata tossicità in pazienti con carcinoma mammario avanzato trattati con Sacituzumab govitecan.
METODI
Attraverso le cartelle elettroniche, sono stati identificati pazienti con carcinoma mammario avanzato trattati con Sacituzumab govitecan, sottoposti a test genetico UGT1A1 e che avevano ricevuto almeno una dose di anticorpo farmaco-coniugato presso City of Hope Comprehensive Cancer Center di Duarte (California). Sono state raccolte informazioni demografiche e oncologiche.
L’obiettivo primario dello studio era valutare se, tra i pazienti con carcinoma mammario trattati con Sacituzumab govitecan, il rischio di interruzione per progressione di malattia fosse più basso nel genotipo omozigosi UGT1A1* 28 rispetto al genotipo WILD-TYPE.
L’obiettivo secondario era valutare se era aumentato il rischio di interruzione del Sacituzumab per tossicità nei pazienti con genotipo omozigosi UGT1A1*28.
RISULTATI
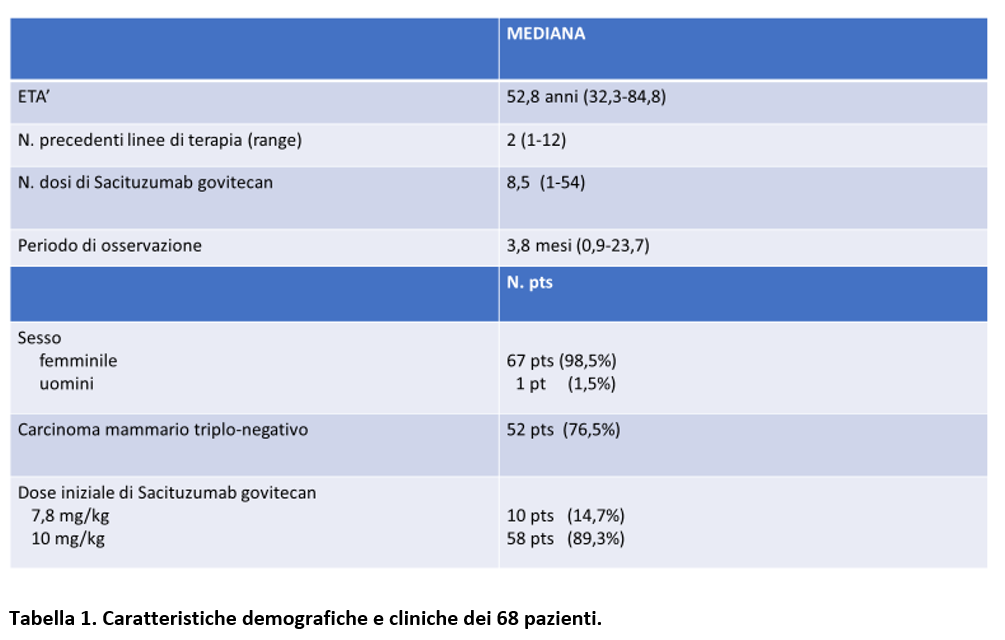
Da Giugno 2020 a Settembre 2022, sono state identificate 67 donne e 1 uomo (Tabella 1) con età mediana di 57,8 anni (range 32,3-84,8). Il 76,5% di questi pazienti (=52) avevano un cancro mammario triplo-negativo.
Prima del trattamento con Sacituzumab govitecan, tutti i pazienti avevano già ricevuto una mediana di 2 linee (range 1-12) di trattamento per la malattia metastatica.
Nella Tabella 2, sono riportati i risultati relativi alla valutazione dei polimorfismi di UGT1A1.
Il polimorfismo più comune è stato UGT1A1*28: in omozigosi in 17 pazienti (25%) ed eterozigosi in 24 (35,3%). I rimanenti 27 pazienti (39,7%) avevano un genotipo Wild Type.
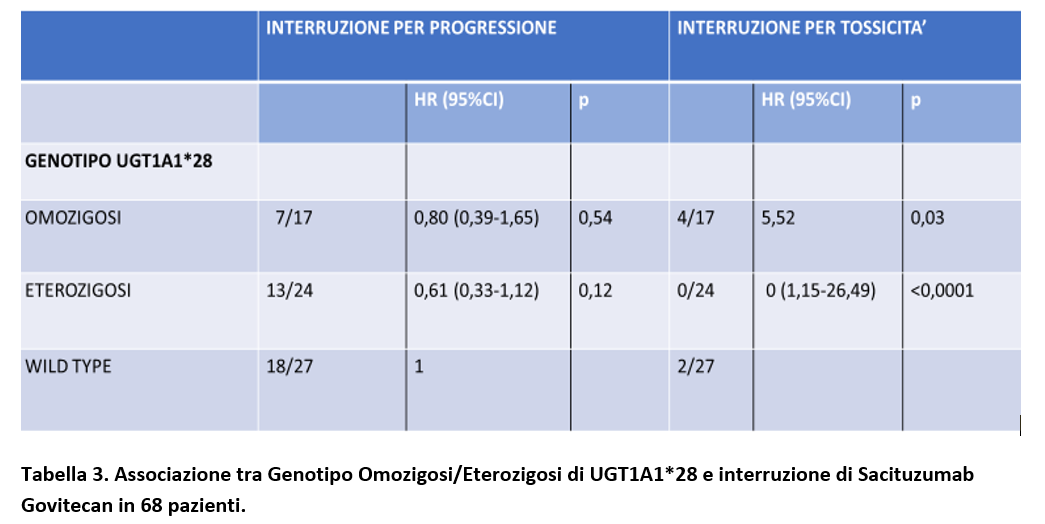
Rispetto al gruppo Wild Type, nel gruppo con omozigosi UGT1A1*28 l’interruzione del trattamento per progressione di malattia non è stata significativamente differente (HR = 0,80; 95% CI 0,39-1,65; p = 0,54) così come nel gruppo eterozigosi UGT1A1*28 (HR = 0,61; CI 0,33-1,12; p = 0,12).
Invece, rispetto al gruppo Wild Type, è stato riportato un significativo aumentato rischio di interruzione di Sacituzumab Govitecan nei pazienti con omozigosi UGT1A1*28 (HR = 5,52; 95% CI 1,15-26,49; p = 0,03) (Tabella 3), ma non nei pazienti con genotipo eterozigosi UGT1A1*28.

CONCLUSIONI
Questo studio retrospettivo condotto in 68 pazienti suggerisce che lo stato di omozigosi UGT1A1*28 è associato ad un aumentato rischio di interruzione di Sacituzumab Govitecan per tossicità rispetto allo stato Wild Type. Non è stata evidenziata una associazione tra omozigosi/eterozigosi UGT1A1*28 e interruzione del farmaco per progressione di malattia.
Valutare il genotipo UGT1A1 potrebbe identificare pazienti ad alto rischio di sviluppo di tossicità a Sacituzumab Govitecan e anche se oggi questa valutazione non è al momento raccomandata nelle correnti linee guida, futuri studi prospettici potrebbero essere utili per confermare il ruolo dei genotipi di UGT1A1 nei pazienti in trattamento con Sacituzumab Govitecan.
COMMENTO
In Italia, da agosto 2022, Sacituzumab govitecan è rimborsato per il trattamento di pazienti adulti con cancro della mammella triplo negativo metastatico o non resecabile (metastatic triple-negative breast cancer, mTNBC) che abbiano ricevuto in precedenza almeno due terapie sistemiche, almeno una delle quali per la malattia avanzata.
L’approvazione di rimborsabilità è stata supportata dai risultati dello studio clinico di fase III ASCENT Bardia A, NEJM 2021), che ha randomizzato pazienti con carcinoma mammario metastatico triplo negativo a ricevere sacituzumab govitecan oppure chemioterapia a scelta del medico (eribulina, vinorelbina, capecitabina oppure gemcitabina). Tutte le pazienti dovevano aver ricevuto due o più linee di chemioterapia per la malattia metastatica e un taxano (paclitaxel o decetaxel- in qualsiasi fase di malattia). Ad un follow up mediano di circa 18 mesi, l’analisi dei risultati eseguita nelle 468 pazienti arruolate senza metastasi cerebrali ha dimostrato che la PFS è stata di 5,6 mesi nelle pazienti trattate con sacituzumab govitecan vs 1,7 mesi nelle pazienti trattate on chemioterapia convenzionale. Tale vantaggio è stato evidenziato anche nelle pazienti che erano già state trattate con immunoterapia. La sopravvivenza mediana globale (OS) è stata calcolata dal momento in cui la paziente è entrata in protocollo ed è risultata essere paria a 12,1 mesi con sacituzumab govitecan rispetto a 6,7 mesi con chemioterapia.
Entrambe queste sopravvivenze sono risultate essere statisticamente superiori con sacituzumab govitecan sia da un punto di vista statistico che clinico.
E’ stato inoltre riportato un tasso di risposte obiettive pari al 35% con sacituzumab govitecan vs 5% con chemioterapia standard.
La tossicità ematologica (leucopenia- riduzione dei globuli bianchi-, neutropenia- riduzione dei neutrofili-, anemia-riduzione dei globuli rossi) e diarrea sono state le tossicità più frequentemente osservate nelle pazienti trattate con sacituzumab govitecan.
Il sacituzumab govitecan ha evidenziato una superiorità rispetto alla chemioterapia tradizionale in termini di sopravvivenza libera da malattia e di sopravvivenza globale anche nell’analisi condotta su tutte le 529 pazienti arruolate, sia con metastasi cerebrali che senza metastasi cerebrali.
I dati finali dello studio ASCENT, relativi all’analisi condotta alla chiusura del data set (25 febbraio 2021) hanno confermato che sacituzumab govitecan ha migliorato la sopravvivenza mediana libera da progressione di malattia (PFS) e la sopravvivenza globale mediana (OS) rispetto alla chemioterapia. Il tasso di sopravvivenza globale (OS) a due anni è stato del 20% nel braccio sacituzumab govitecan rispetto al 5% nel braccio chemioterapia scelta dal medico (Bardia A, JCO 2022).
Metabolismo del sacituzumab govitecan.
L’SN-38 (chemioterapico componente di sacituzumab govitecan) è metabolizzato dalla uridina difosfato glucuronosil transferasi (UGT1A1). Le varianti genetiche del gene UGT1A1 come l’allele UGT1A1*28 riducono l’attività dell’enzima UGT1A1. Gli individui che sono omozigoti per l’allele UGT1A1*28 sono a rischio maggiore di neutropenia, neutropenia febbrile e anemia nonché di altre reazioni avverse dopo l’inizio del trattamento con sacituzumab govitecan. Circa il 20% della popolazione nera, il 10% della popolazione bianca e il 2% della popolazione dell’Asia Orientale è omozigote per l’allele UGT1A1*28. In alcune popolazioni possono essere presenti alleli con funzionalità ridotta diversi da UGT1A1*28. I pazienti con nota attività ridotta di UGT1A1 devono essere attentamente monitorati per individuare eventuali reazioni avverse. Se non nota, non è necessario eseguire il test dello stato dell’UGT1A1 poiché la gestione delle reazioni avverse, incluse le modifiche della dose raccomandate, è la stessa per tutti i pazienti.
Interazioni con altri medicinali ed altre forme d’interazione
Non sono stati effettuati studi d’interazione. Inibitori dell’UGT1A1 La somministrazione concomitante di sacituzumab govitecan con inibitori dell’UGT1A1 può aumentare l’incidenza di reazioni avverse dovute al potenziale aumento dell’esposizione sistemica a 7 SN-38.
Sacituzumab govitecan deve essere impiegato con cautela nei pazienti che assumono inibitori dell’UGT1A1 (ed esempio, propofol, ketoconazolo, inibitori delle tirosin chinasi dell’EGFR). Induttori dell’UGT1A1 L’esposizione a SN-38 può essere ridotta nei pazienti co-trattati con induttori dell’enzima UGT1A1.
Sacituzumab govitecan deve essere impiegato con cautela nei pazienti che assumono induttori dell’UGT1A1 (ed esempio, carbamezapina, fenitoina, rifampicina, ritonavir e tipranavir). In base ai dati limitati disponibili derivanti da pazienti che avevano ricevuto inibitori (n=16) o induttori (n=5) dell’UGT1A1 mentre erano trattati con sacituzumab govitecan, le esposizioni a SN-38 in questi pazienti erano comparabili a quelle dei pazienti che non avevano ricevuto inibitori o induttori dell’UGT1A1.
BIBLIOGRAFIA
- Takano M, Sugiyama T. UGT1A1 polymorphisms in cancer: impact on irinotecan treatment. Pharmacogenomics Pers Med 2017; 28 (10): 61-68.
- Bardia A, Hurvitz SA, Tolaney SM, Loirat D, Punie K, Oliveira M, Brufsky A, Sardesai SD, Kalinsky K, Zelnak AB, Weaver R, Traina T, Dalenc F, Aftimos P, Lynce F, Diab S, Cortés J, O’Shaughnessy J, Diéras V, Ferrario C, Schmid P, Carey LA, Gianni L, Piccart MJ, Loibl S, Goldenberg DM, Hong Q, Olivo MS, Itri LM, Rugo HS; ASCENT Clinical Trial Investigators.Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med 2021; 384:1529-41
3. Bardia A, Tolaney SM, Loirat D et al. Sacituzumab govitecan (SG) versus treatment of physician’s choice (TPC) in patients (pts) with previously treated, metastatic triple-negative breast cancer (mTNBC): Final results from the phase 3 ASCENT study. JCO 2022; 40(issue16): Abstract #1017
- Baek G, Jung L, Duong A, Gralow J. Case report of sacituzumab govitecan-hziy-induced neutropenia in a patient with metastatic triple-negative breast cancer and a uridine diphosphate glucuronosyltransferase family 1 member A1 poor metabolizer genotype. J Oncol Pharm Pract. 2022 Apr;28(3):710-716.
- Bardia A, Mayer IA, Vahdat LT, et al. Sacituzumab Govitecan-hziy in Refractory Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2019 Feb 21;380(8):741-751.
- Ibrahim R, Khoury R, Ibrahim T, Le Cesne A, Assi T. UGT1A1 Testing in Breast Cancer: should it become routine practice in patients treated with antibody-drug conjugates? Crit Rev Oncol Hematol. 2024 Apr;196:104265.


