
NEOADJUVANT CHEMOTHERAPY WITH OXALIPLATIN AND FLUOROPYRIMIDINE VERSUS UPFRONT SURGERY FOR LOCALLY ADVANCED COLON CANCER: THE RANDOMIZED, PHASE III OPTICAL TRIAL.
Hu H, Zhang J, Li Y, Wang X, Wang Z, Wang H, Kang L, Liu P, Lan P, Wu X, Zhen Y, Pei H, Huang Z, Zhang H, Chen W, Zeng Y, Lai J, Wei H, Huang X, Chen J, Chen J, Tao K, Xu Q, Peng X, Liang J, Cai G, Ding K, Ding Z, Hu M, Zhang W, Tang B, Hong C, Cao J, Huang Z, Cao W, Li F, Wang X, Wang C, Huang Y, Zhao Y, Cai Y, Ling J, Xie X, Wu Z, Shi L, Ling L, Liu H, Wang J, Huang M, Deng Y; OPTICAL study group.
J Clin Oncol. 2024 Sep 1;42(25):2978-2988. doi: 10.1200/JCO.23.01889.
Il carcinoma del colon retto è il terzo tumore più frequentemente diagnosticato e rappresenta la seconda causa di morte per cancro al mondo.
La chirurgia seguita da chemioterapia adiuvante basata su Oxaliplatino è lo standard per il cancro del colon Stadio III e Stadio II ad alto rischio, ma il 20%-30% dei pazienti nel tempo sviluppa una ripresa di malattia. La DFS a 3 anni dopo chemioterapia adiuvante per 6 mesi rimane comunque bassa, pari al 64%, nei pazienti ad alto rischio (T4 e/o N2) (Grothey A. 2018).
I vari studi che hanno valutato Irinotecan e che hanno incorporato agenti come bevacizumab e cetuximab nel setting adiuvante per aumentare la prognosi del carcinoma del colon hanno dato risultati negativi.
La chemioterapia neo-adiuvante (NAC) ha il potenziale di ridurre le dimensioni del tumore, il rischio di resezione incompleta, e di diffusione delle cellule tumorali, e, rispetto alla terapia adiuvante, di eliminare più efficacemente le micrometastasi.
Varie evidenze supportano l’utilizzo di un trattamento neo-adiuvante ( NAC) nella neoplasia localmente avanzata del colon retto:
- lo studio di fase III FOXTROT ha dimostrato che 6 settimane di NAC con oxaliplatino + fluoropirimidina determina marcato doWnSTAGING patologico, minor numero di resezioni incomplete e miglior controllo di malattia a 2 anni (MORTON D. , 2023);
- lo studio randomizzato di fase II PRODIGE 22 ha dimostrato che 4 cicli di FOLFOX perioperatorio non sono gravati da eccessiva tossicità e permettono di ottenere un tasso di risposta patologica maggiore nell’8% dei casi;
- lo studio NeoCoL che confronta NAC (CAPOX x 3 cicli o FOLFOX x 4 cicli) rispetto alla chirurgia UP FRONT ha evidenziato tassi di DFS a 2 anni e OS simili, ma con potenziale vantaggio della NAC nel ridurre le complicanze postoperatori e nel downstaging del tumore.
Pur avendo varie metanalisi riportato sicurezza della NAC e benefici in termini di downstaging con un aumentato tasso di resezioni RO, permangono ancora delle controversie riguardo l’impatto della NAC sulla sopravvivenza globale.
Lo studio OPTICAL è stato disegnato per valutare se 3 mesi di mFOLFOX 6 o CAPOX come chemioterapia neo-adiuvante (NAC) possano aumentare gli OUTCOMES nei pazienti con cancro del colon localmente avanzato rispetto alla chirurgia upfront.
PAZIENTI E METODI
Lo studio di fase III OPTICAL, randomizzato, multicentrico, è stato condotto in 28 ospedali della Cina
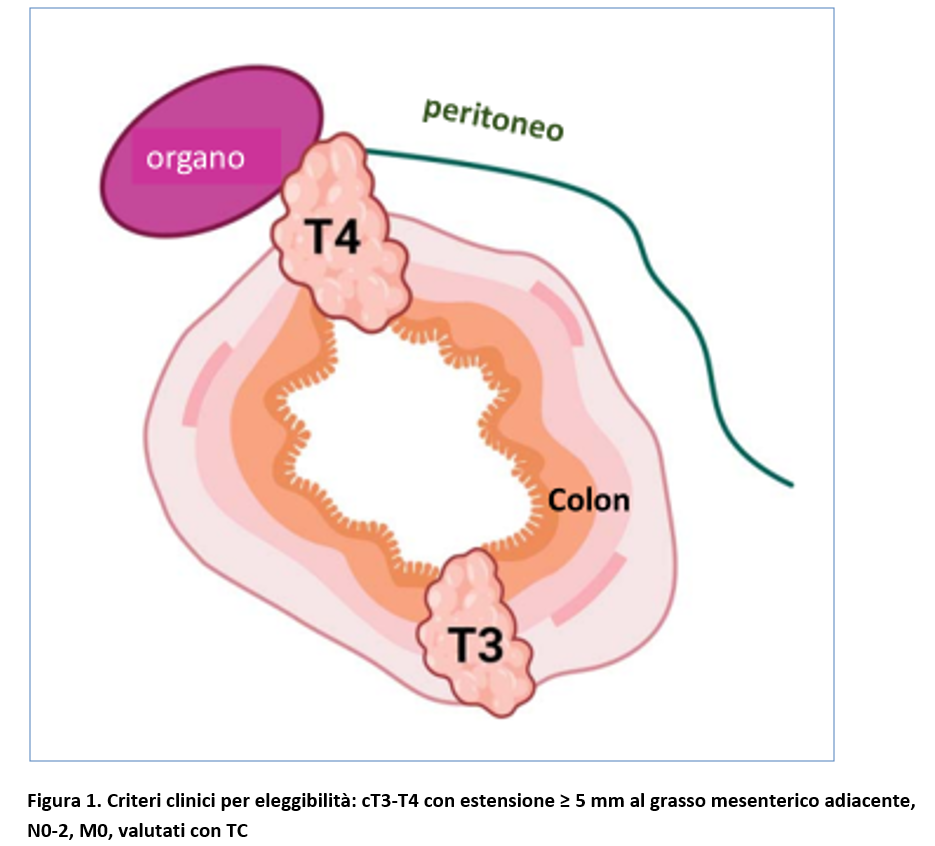
I pazienti erano elegibili in caso di (Figura 1):
- età 18-75 anni;
- adenocarcinoma del colon comprovato da biopsia, con estensione distale a meno di 12 cm dal margine anale;
- stadio clinico di malattia localmente avanzata (cT4 o cT3 con estensione al grasso pericolico con estensione al grasso mesenterico adiacente) ≥ 5mm;
- qualsiasi stadio clinico linfonodale, valutato radiologicamente con tomografia computerizzata (TC).
Criteri di esclusione erano rappresentati da:
- presenza di malattia metastatica (M1);
- adenocarcinoma del colon non resecabile o ricorrente;
- ostruzione, perforazione o sanguinamento richiedente un interventochirurgico
I pazienti elegibili sono stati randomizzati (1:1) a ricevere chemioterapia neo-adiuvante oppure chirurgia upfront (Figura 2).
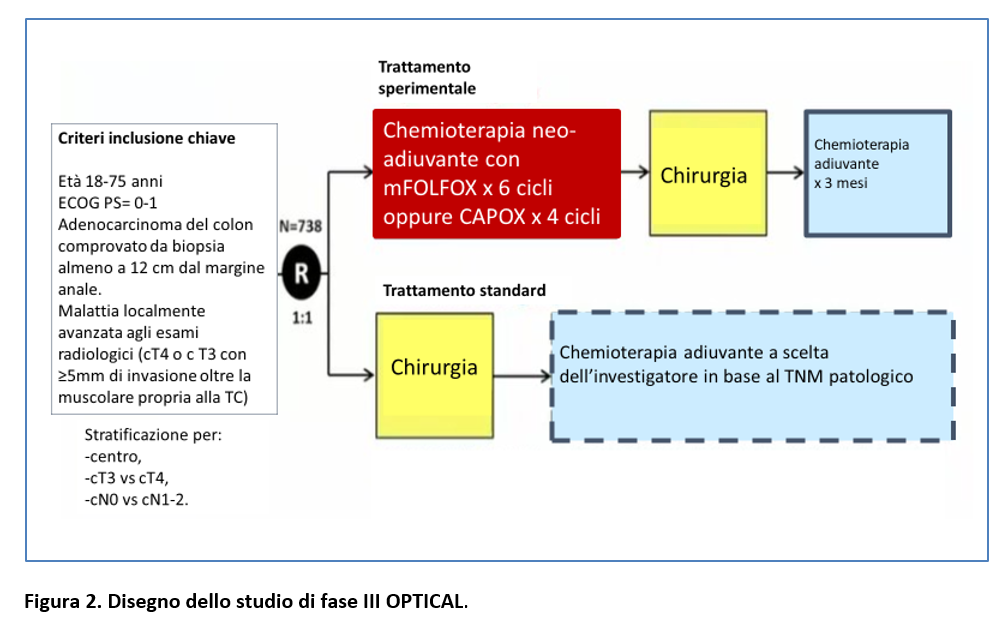
La chemioterapia neoadiuvante consisteva in 6 cicli di mFolfox oppure 4 cicli di CAPOX (Figura 3).
La chirurgia era programmata 4 settimane dopo l’ultimo ciclo di chemioterapia neo-adiuvante.
La chemioterapia adiuvante veniva effettuata somministrando lo stesso regime utilizzato in fase neo-adiuvante.
Nel gruppo Chirurgia Upfront, i pazienti sono stati sottoposti a chirurgia appena possibile, dopo la randomizzazione, e in quelli con stadio patologico II e III veniva raccomandata chemioterapia adiuvante basata su fluoropirimidina.

La valutazione radiologica con TC torace-addome-pelvi veniva effettuata al basale in tutti i pazienti randomizzati e, nel gruppo chemioterapia neo-adiuvante (NAC) dopo 3° ciclo di mFOLFOX o 2°di CAPOX e prima della chirurgia.
Dopo la chirurgia, una TC veniva effettuata ogni 6 mesi negli anni 1-3 e ogni 12 mesi negli anni 4-5.
L’endpoint primario dello studio era la DFS a 3 anni definita come il tempo intercorso tra la randomizzazione e uno dei seguenti eventi (a seconda di quale sia il primo a verificarsi):
- malattia in progressione locale che determina una non-resecabilità del tumore;
- resezione locale R2;
- ripresa locale dopo resezione R0/R1;
- metastasi a distanza;
- insorgenza di una nuova neoplasia primitiva del colon;
- morte per qualsiasi causa.
Gli endpoint secondari comprendevano:
- resezione R0;
- risposta patologica completa (pCR);
- stadio patologico TNM;
- grado di regressione tumorale- TRG- secondo AJCC (Trakarnsanga A. , 2014);
- Sopravvivenza globale (OS);
- morbidità e mortalità;
- eventi avversi (secondo NCI-CT CAE v.5.0).
RISULTATI
Tra gennaio 2016 e aprile 2021 sono stati arruolati 752 pazienti in 28 ospedali cinesi e randomizzati a NAC (=376) o chirurgia upfront (=376).
Un totale di 744 pazienti sono stati inclusi nella analisi della popolazione “intention-to-treat modificata-mITT” (che escludeva tutti i pazienti randomizzati che avevano ritirato il consenso o erano risultati inelegibili).
Globalmente, i pazienti presentavano una età mediana di 56 anni; 561 pazienti (75%) avevano tumori cT4 e 574 (77%) cN1-2.
TRATTAMENTO
- NAC (chemioterapia neo-adiuvante)
I dati sono disponibili per 340 su 371 pazienti nel gruppo NAC, i quali avevano iniziato NAC (238- pari al 70%- avevano ricevuto mFOLFOX6 e 102- pari al 30%- CAPOX).
Durante la chemioterapia neoadiuvante, 4 pazienti hanno presentato progressione di malattia e 1 paziente ha sviluppato metastasi a distanza.
Eventi avversi di grado 3-4 si sono registrati nel 29% dei pazienti (98/340) e il più comune è stato la neutropenia (16%) e anemia (11%) in coloro che avevano ricevuto m FOLFOX 6, e anemia (9%) e sindrome mano-piedi (5%) in quelli trattati con CAPOX.
- Chirurgia
Nel gruppo di chemioterapia neo-adiuvante, il 98% (366/371) dei pazienti è stato sottoposto a chirurgia. Nel gruppo CHIRURGIA UPFRONT, tutti i 373 pazienti sono stati operati. Non sono state osservate differenze tra i due gruppi relativamente a resezione del tumore primario (99% vs 100%) e approccio laparoscopico (81% vs 83%).
Una resezione RO è stata ottenuta nel 98% dei pazienti operati, in entrambi i gruppi. Simile è stato il tasso di complicanze chirurgiche (13% vs 15%), il tempo di durata mediana dell’intervento (191 vs 190 minuti) e di degenza postoperatoria (8 giorni). Nessun decesso si è verificato nei 30 giorni dalla chirurgia.
- Chirurgia adiuvante
Delle 699 pazienti elegibili per la chemioterapia adiuvante, l’83% (298/358) del gruppo NAC e l’80% (273/341) del gruppo chirurgia UPFRONT hanno iniziato chemioterapia e il 58% (gruppo NAC) e il 65% (gruppo chirurgia) hanno ricevuto almeno 3 mesi di terapia adiuvante. Il più frequente evento avverso di grado 3-4 è stato la neutropenia (14% nel gruppo NAC e 12% nel gruppo chirurgia). Non si sono verificati decessi.
OUTCOME DI EFFICACIA
- Caratteristiche Patologiche
La somministrazione di chemioterapia neoadiuvante è stata associata, rispetto alla chirurgia upfront, a tassi significamente più bassi di:
stadi di malattia localmente avanzata (pT3-T4: 76% vs 94%; p < 0,001),
metastasi linfonodali (pN1-2: 32% vs 47%, p < 0,001),
invasione perineurale (9% vs 17%; p = 0,001).
Nel gruppo NAC, il 7% dei pazienti ha ottenuto una pCR. Il 9% dei pazienti ha avuto una regressione tumorale grado 0, il 10% di grado 1 il 44% di grado 2 e il 38% di grado 3. Una mancata regressione tumorale è stata più frequente nei pazienti senza alterazioni del mismatch repair (pMMR) rispetto a quelli con deficienza del mismatch repair (dMMR) : 21% vs 5%.
- Disease-Free Survival (DFS) e Overall Survival (OS)
Alla data del cutoff per questa analisi (15 marzo 2023) il follow up mediano è stato di 46,7 mesi per il gruppo NAC e 49,8 per il gruppo SURGERY UPFRONT.
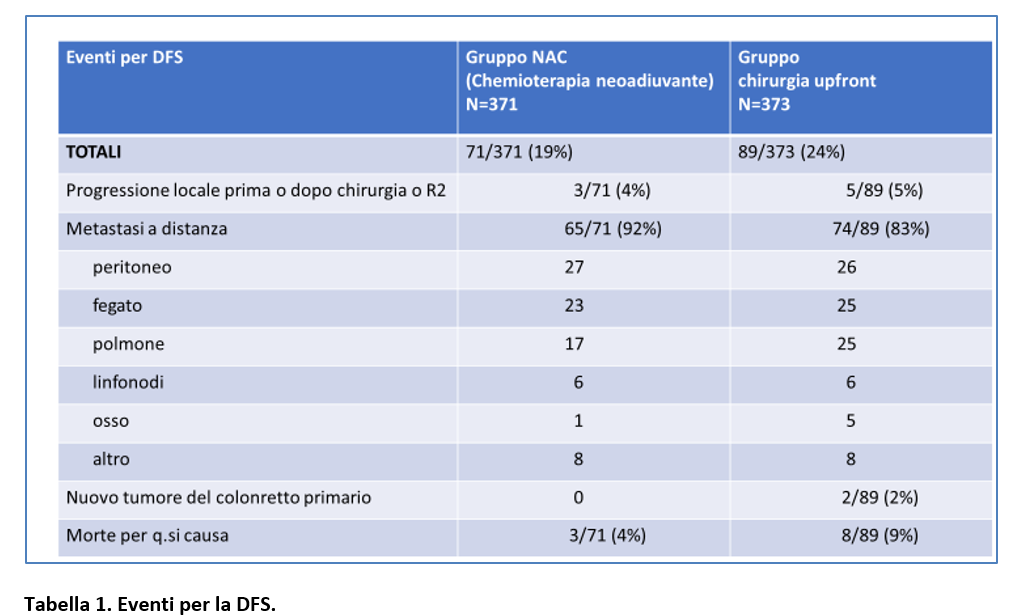
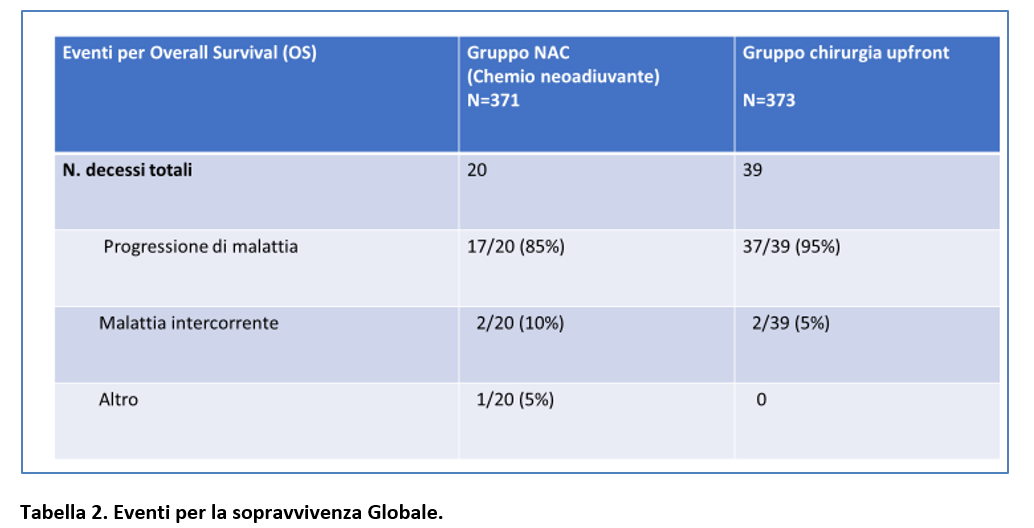
Nella Tabella 1 sono riportati gli eventi per la DFS. Nella Tabella 2 sono riportati i decessi verificatesi nei due gruppi di trattamento e le cause del decesso.
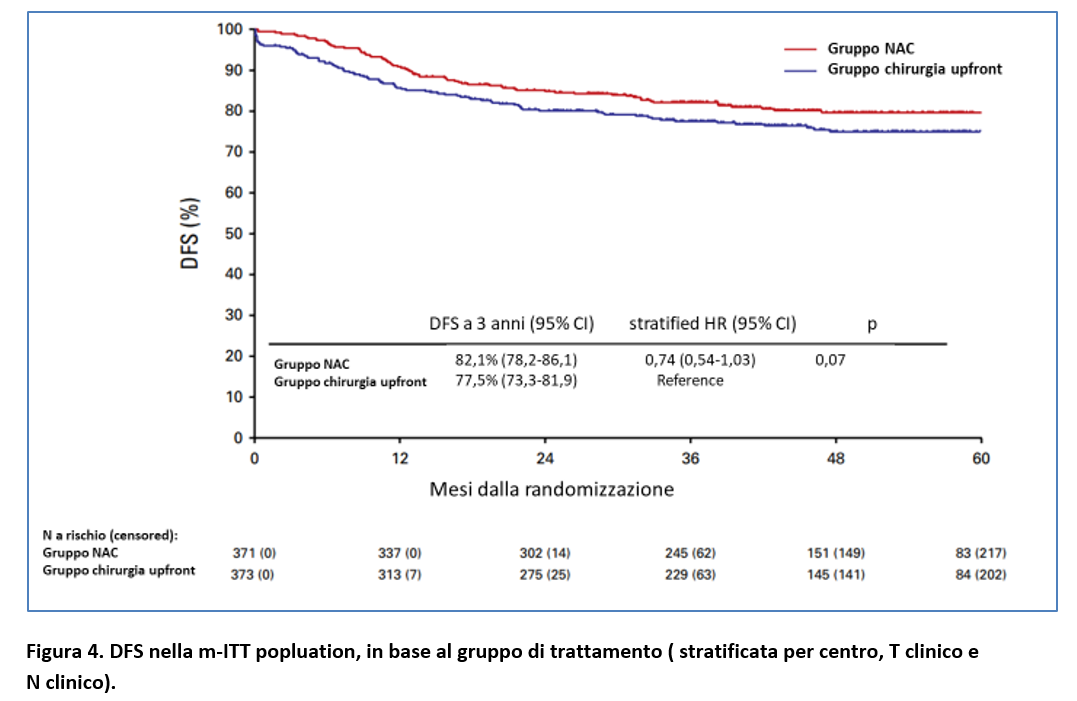
I tassi di DFS a 3 anni (endpoint primario) sono stati dell’82,1% (95% CI, 78,2-86,1) nel gruppo NAC e del 75% (95% CI, 73,3-81,9) nel gruppo chirurgia upfront (Figura 4). L’HR stratificato è stato pari allo 0,74 (95% CI, 0,54-1,03); p = 0,07.
Nella analisi di sottogruppo della DFS non è stato evidenziato un significativo effetto di interazione tra i due gruppi di trattamento e le caratteristiche basali, se non per il sesso ( p = 0,40 per interazione). Tra le pazienti di sesso femminile, il guadagno in DFS a 3 anni è stato osservato nel gruppo chirurgia upfront con stratified HR= 0,54 (95% CI, 0,30-0,95).
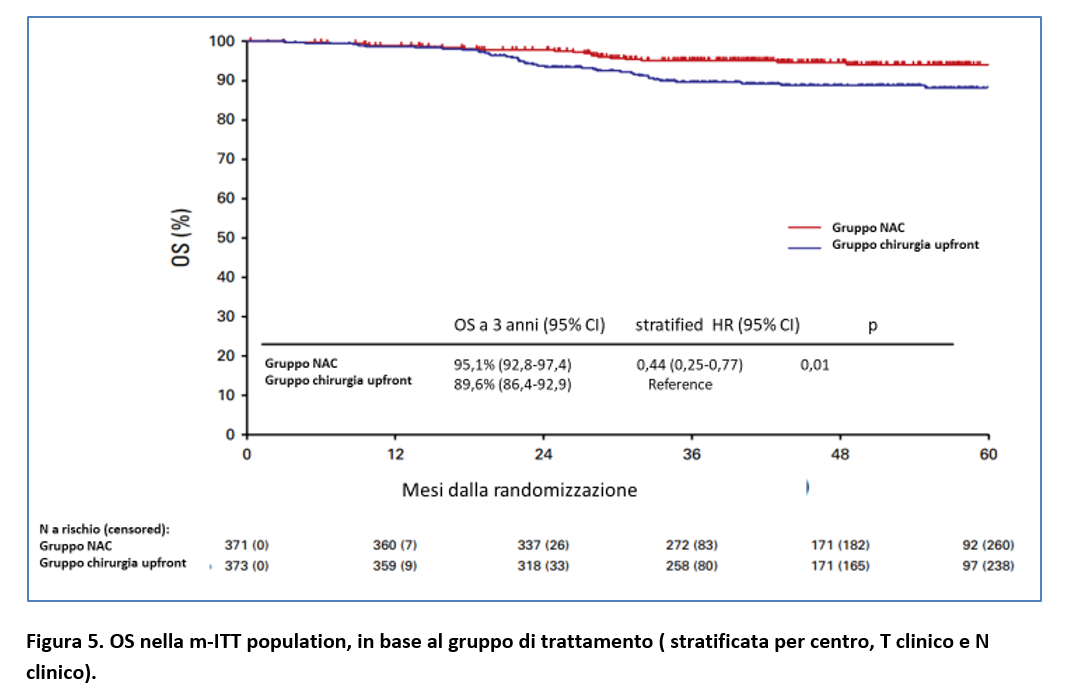
I tassi di sopravvivenza globale (OS) a 3 anni e i tassi di sopravvivenza cancro-specifica a 3 anni sono riportati nella Tabella 3 e Figura 5.

CONCLUSIONI
Lo studio OPTICAL non ha evidenziato un vantaggio statisticamente significativo in DFS a 3 anni con la somministrazione di chemioterapia neoadiuvante in pazienti con cancro del colon localmente avanzato (stratified HR = 0,74; 95% CI, 0,54-1,03).
D’altra parte, l’approccio con chemioterapia neo-adiuvante è sicuro e fattibile e determina un 7% di pCR, un sostanziale downstaging patologico rispetto alla chirurgia upfront e un potenziale beneficio in OS a 3 anni (95,1% vs 89,6%; stratified HR=0,44; P=0,01).
Da sottolineare che una scarsa regressione tumorale è stata osservata nei tumori con deficit del mismatch repair.
BIBLIOGRAFIA
Grothey A, Sobrero AF, Shields AF, et al: Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med 378:1177-1188, 2018
Morton D, Seymour M, Magill L, et al: Preoperative chemotherapy for operable colon cancer: Mature results of an international randomized controlled trial. J Clin Oncol 41:1541-1552, 2023
Trakarnsanga A, Gonen M, Shia J, et al: Comparison of tumor regression grade systems for locally advanced rectal cancer after multimodality treatment. J Natl Cancer Inst 106:dju248, 2014
Link all’abstract:
https://pubmed.ncbi.nlm.nih.gov/38564700/
