
NEOADJUVANT DOCETAXEL, OXALIPLATIN, AND S-1 PLUS SURGERY AND ADJUVANT S-1 FOR RESECTABLE ADVANCED GASTRIC CANCER: UPDATED OVERALL SURVIVAL OUTCOMES FROM PHASE III PRODIGY.
Kang YK, Kim HD, Yook JH, Park YK, Lee JS, Kim YW, Kim JY, Ryu MH, Rha SY, Chung IJ, Kim IH, Oh SC, Park YS, Cheong JH, Jeong O, Heo MH, Kim HK, Park C, Yoo CH, Kang SY, Zang DY, Jang YJ, Sul JY, Kim JG, Kim BS, Beom SH, Hwang JE, Ryu SW, Kook MC, Ryoo BY, Kim H, Yoo MW, Lee NS, Lee SH, Noh SH.
J Clin Oncol. 2024 Sep 1;42(25):2961-2965. doi: 10.1200/JCO.23.02167
La terapia adiuvante e neo-adiuvante del carcinoma gastrico localmente avanzato resecabile sono differenti nelle diverse regioni del mondo: In Europa lo standard è rappresentato dalla chemioterapia peri-operatoria, in Asia dalla gastrectomia con linfoadenectomia D2 seguita da chemioterapia adiuvante mentre nel Nord America è rappresentato dalla chemioterapia post- chirurgia.
Recentemente, due studi clinici di fase III hanno evidenziato un beneficio clinico della chemioterapia neo-adiuvante nelle popolazioni asiatiche.
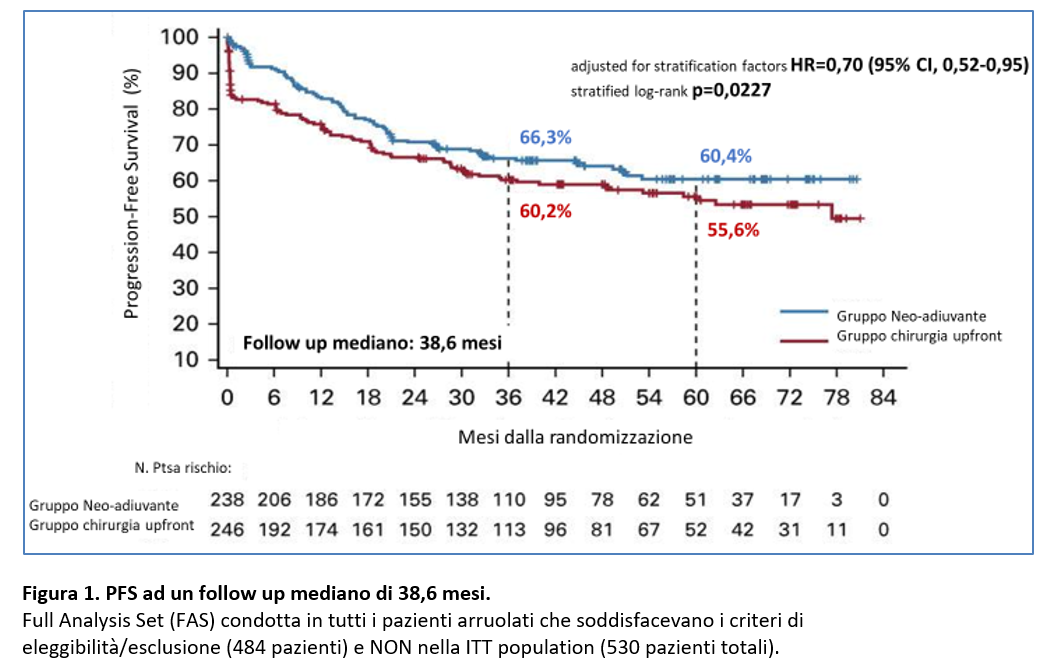
- Lo studio PRODIGY (Kang Y.K., 2021) ha dimostrato, ad un follow up mediano di 38,6 mesi, un vantaggio in PFS a 3 anni in pazienti sottoposti a chemioterapia neo-adiuvante con docetaxel + oxaliplatino + S-1 (Tegafur) seguita da chirurgia e successiva chemioterapia adiuvante con S-1 rispetto a chirurgia upfront seguita da chemioterapia adiuvante con S-1 nei pazienti con carcinoma gastrico localmente avanzato resecabile cT2/T3 N+ oppure cT4/q.si N.
Il tasso di PFS a 3 anni è del 66,3 % gruppo nel gruppo chemioterapia neoadiuvante versus
60,2% nel gruppo chirurgia upfront: 60,2%(HR = 0,70;95% CI, 0,52-0,95; p= 0,023).
- Lo studio RESOLVE (Zhang X., 2021) ha dimostrato che la chemioterapia peri-operatoria con Oxaliplatino + S-1 aumenta la DFS rispetto alla chirurgia upfront seguita da chemioterapia adiuvante (capecitabina+ oxaliplatino).
Nello studio PRODIGY, al momento dell’analisi pianificata per l’endpoint primario, la PFS, pubblicata nel 2021 (Kang Y.K., 2021) (Figura 1) erano immaturi i dati per la sopravvivenza globale (OS), che rappresentava uno degli endpoint secondari.
In questo articolo recentemente pubblicato sono stati aggiornati i dati in merito alla OS con un follow up mediano di 99,5 mesi (data cutoff: Settembre 2022).
PAZIENTI E METODI
Il disegno dello studio clinico di fase III, open-label, randomizzato, è riportato nella Figura 2, così come i criteri di inclusione. I pazienti venivano randomizzati nel gruppo chemioterapia neo-adiuvante oppure nel gruppo chirurgia upfront.
I criteri chiave di inclusione sono riportati nella Figura 2. Da sottolineare che i pazienti sono stati considerati linfonodi positivi (N+) se, indipendentemente dalla forma del linfonodo, l’asse minore era ≥ 8 mm o il diametro minore era ≥ 5 mm con necrosi centrale, forma tondeggiante, infiltrazione perilinfonodale o enhancement radiologica evidente/rilevante.
La randomizzazione prevedeva una stratificazione per centro e per stadio cTNM (Figura 2).
La chemioterapia neoadiuvante (schema DOS) prevedeva:
- Docetaxel 50 mg/IV/mq/dei 1
- Oxaliplatino 100 mg/IV/mq/dei 1
- S-1: 40 mg/mq/os/due volte al giorno-dei 1
 14
14 - Cicli ogni 3 settimane x 3 cicli
La chirurgia prevedeva gastrectomia D2 1-3 settimane dopo la chemioterapia neo-adiuvante oppure, nel gruppo chirurgia upfront, entro 2 settimane della randomizzazione.
In entrambi i gruppi era prevista chemioterapia adiuvante con S-1 (40-60 mg/os/due volte al giorno dei 1-28, ogni 6 settimane per 8 cicli).
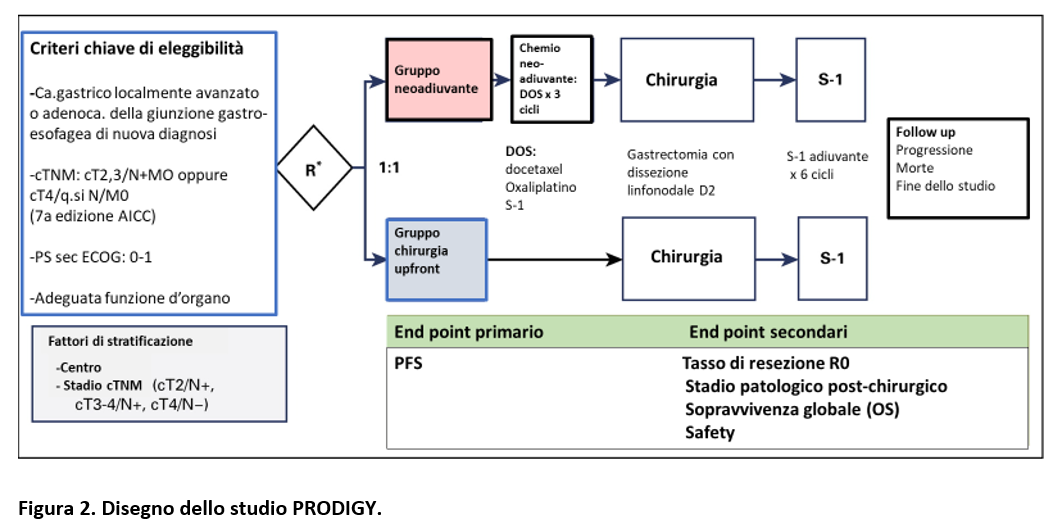
L’endpoint primario dello studio era la PFS; la OS era uno degli endpoint secondari. In questa analisi sono riportate le valutazioni finali delle sopravvivenze eseguite dopo 5 anni dall’arruolamento dell’ultimo paziente.
L’analisi “intention-to-treat” (ITT) includeva tutti i pazienti randomizzati. La “full analysis set” (FAS) includeva tutti i pazienti randomizzati che soddisfacevano i criteri di inclusione/esclusione. La data del cutoff per questa analisi finale è stata: Settembre 2022.
RISULTATI
Sono stati randomizzati un totale di 530 pazienti (ITT population): dopo l’esclusione di 46 pazienti (violazione dei criteri di eleggibilità o ritiro del consenso), hanno iniziato il trattamento previsto: 238 pazienti nel gruppo neo-adiuvante e 246 nel gruppo chirurgia upfront. Ad un follow up mediano di 38,6 mesi, all’analisi primaria dello PFS -endpoint primario dello studio- era stato evidenziato un vantaggio in PFS a 3 anni (Figura 2) nella popolazione di pazienti randomizzati e assegnati al trattamento che soddisfacevano i criteri di inclusione/esclusione (Full Analysis Set-FAS).
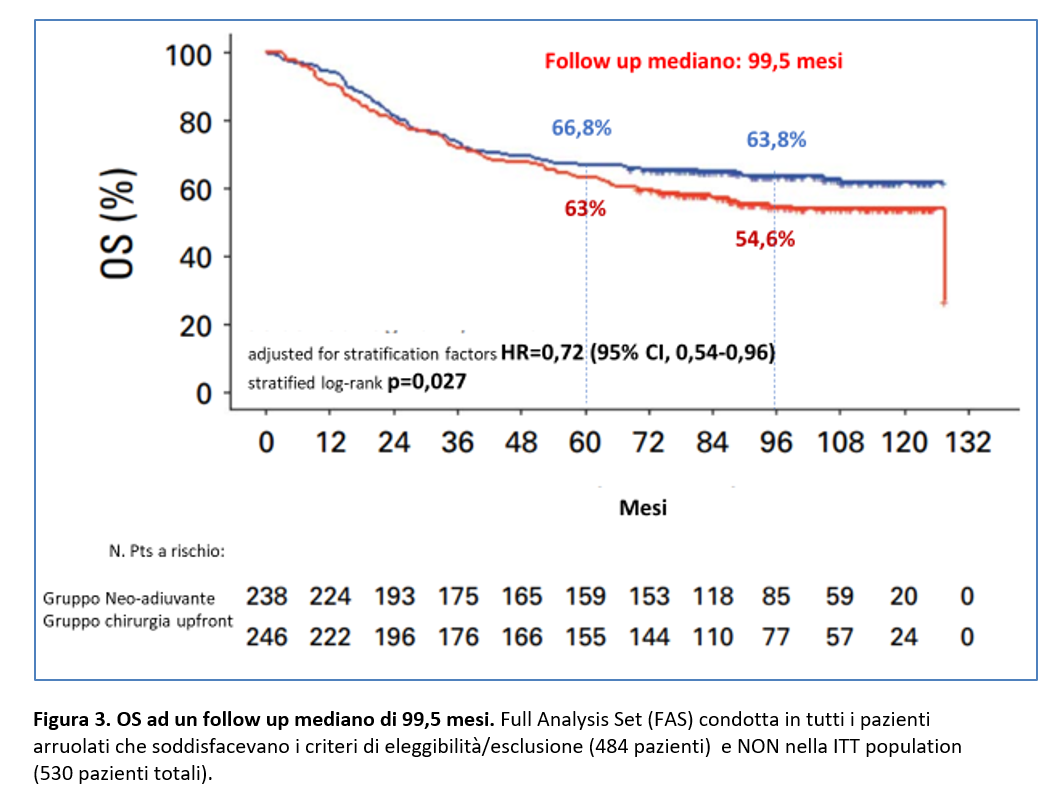
In questa analisi, ad un follow up mediano di 99,5 mesi (range: 68,4-127,4), erano deceduti 87 (36,6%) pazienti nel gruppo chemioterapia neo-adiuvante vs 111 (45,1%) nel gruppo chirurgia upfront (adjusted HR = 0,72; 95% CI, 0,54-0,96 ; stratificated log-rank p = 0,027).
I tassi di sopravvivenza globale a 5 anni sono stati pari a 66,8% (95% CI, 61,1-73,1) e 63% (95% CI, 57,3-69,3)rispettivamente nel gruppo terapia neoadiuvante versus chirurgia upfront.
I tassi di OS a 8 anni sono stati pari a 63,8% (95% CI, 57,9-70,3) e 54,6% (95% CI, 48,6-61,4) a vantaggio della terapia neoadiuvante (Figura 3).
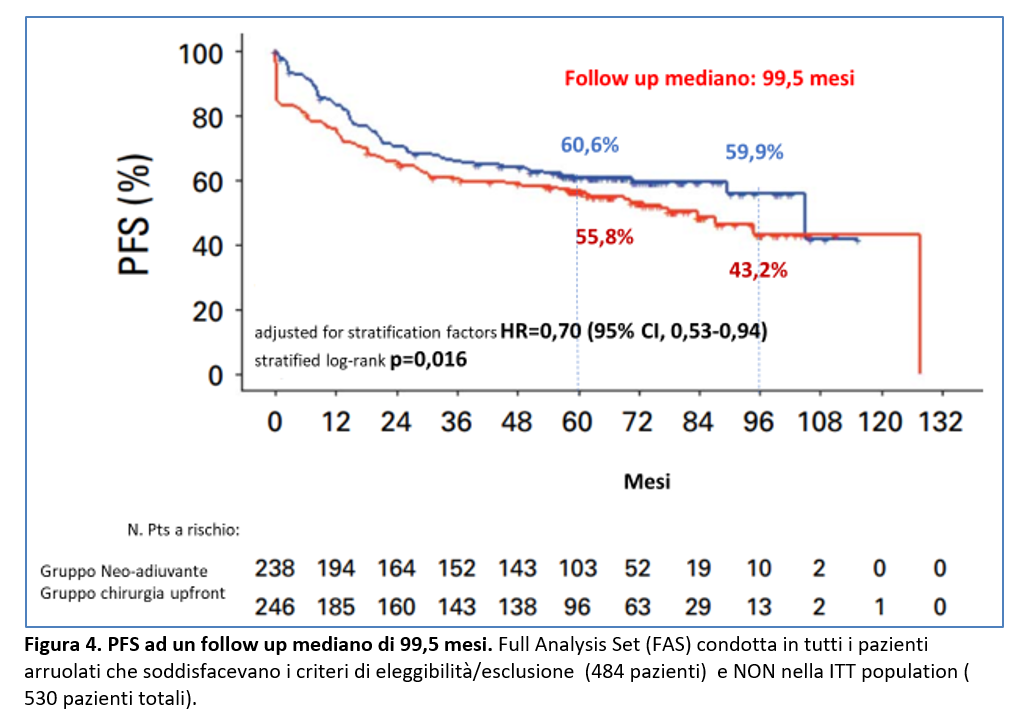
Sono stati aggiornati anche i dati della PFS con un follow up mediano di 99,5 mesi.
Gli eventi per la PFS sono stati riportati in 94 (39,5%) pazienti del gruppo neo-adiuvante e in e in 117 (47,6%) pazienti del gruppo chirurgia.
I dati attuali confermano il vantaggio in PFS già evidenziato nella precedente analisi con incremento di PFS nel gruppo sottoposto a terapia neoadiuvante (Figura 4).
Anche i risultati dell’analisi sulla “ITT population” hanno confermato che la chemioterapia neo-adiuvante aumenta significativamente la OS e la PFS.
CONCLUSIONI
I dati dello studio PRODIGY dimostrano che la chemioterapia neoadiuvante secondo lo schema DOS ( docetaxel+oxaliplatino+S-1) seguita da chirurgia D2 e chemioterapia adiuvante con S-1 è efficace nei pazienti coreani con carcinoma gastrico avanzato resecabile. Prolungando la PFS e la OS potrebbe essere considerata una delle opzioni per i pazienti asiatici.
BIBLIOGRAFIA
1.Kang YK, Yook JH, Park YK, et al: Prodigy: A phase III study of neoadjuvant docetaxel, oxaliplatin, and S-1 plus surgery and adjuvant S-1 versus surgery and adjuvant S-1 for resectable advanced gastric cancer. J Clin Oncol 39:2903-2913, 2021
https://pubmed.ncbi.nlm.nih.gov/34133211/
Free Full Text- PMC
2.Zhang X, Liang H, Li Z, et al: Perioperative or postoperative adjuvant oxaliplatin with S-1 versus adjuvant oxaliplatin with capecitabine in patients with locally advanced gastric or gastrooesophageal junction adenocarcinoma undergoing D2 gastrectomy (RESOLVE): An open-label, superiority and non-inferiority, phase 3 randomised controlled trial. Lancet Oncol 22:1081-1092, 2021.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/38996201/

