
OXALIPLATIN-BASED ADJUVANT CHEMOTHERAPY IN OLDER PATIENTS WITH STAGE III COLON CANCER: AN ACCENT/IDEA POOLED ANALYSIS OF 12 TRIALS.
Gallois C, Shi Q, Pederson LD, André T, Iveson TJ, Sobrero AF, Alberts S, de Gramont A, Meyerhardt JA, George T, Schmoll HE, Souglakos I, Harkin A, Labianca R, Sinicrope FA, Oki E, Shields AF, Boukovinas I, Kerr R, Lonardi S, Yothers G, Yoshino T, Goldberg RM, Taieb J, Papamichael D.
J Clin Oncol 2024 Jul 1;42(19):2295-2305. doi: 10.1200/JCO.23.01326. Epub 2024 Mar 28. PMID: 38547438.
Il 25% dei pazienti con diagnosi di carcinoma del colon si presenta con una malattia allo stadio III. In questi pazienti, la chemioterapia adiuvante con fluoropirimidina associata a Oxaplatino ha determinato un beneficio in DFS a 5 anni del 6-7% e in OS a 5 anni del 3-4% rispetto ai risultati ottenuti negli studi randomizzati di fase III con l’utilizzo di fluoropirimidina in monoterapia.
L’età mediana alla diagnosi di carcinoma del colon è circa 70 anni nei Paesi occidentali. Tuttavia, solo il 14-20% dei pazienti arruolati in studi di terapia adiuvante ha più di 70 anni. Rimane quindi controverso il beneficio derivante dall’aggiunta di oxaliplatino alla fluoropirimidina in questa fascia d’età, essendo inoltre tuttora attesi i risultati finali dello studio di fase III ADAGE, volto a indagare i reali benefici della terapia adiuvante nei pazienti anziani.
I dati oggi disponibili relativi all’uso della chemioterapia adiuvante contenente oxaliplatino nei pazienti ultra 70enni sono pertanto controversi.
Una pooled analysis degli studi NSABP-C07 e XELOXA ha evidenziato che i pazienti ≥ 70 anni non hanno un singnificativo miglioramento della DFS, OS e TTR (Time To Recurrence) con l’aggiunta dell’oxaliplatino. Questa analisi non ha trovato interazioni statisticamente significative tra gruppi di trattamento ed età per tutti e tre gli endpoints, pur suggerendo che un sottogruppo di pazienti anziani possa ottenere un beneficio dall’aggiunta dell’oxoliplatino alla fluoropirimidine. Risultati contrastanti sono stati ottenuti in una ulteriore “pooled analysis” di 4 studi (NSPABP-C-08, XELOXA, X-ACT e AVANT)che ha evidenziato un beneficio in DFS dall’aggiunta di oxaliplatino indipendentemente dall’età o dalle comorbidità.
Va sottolineato inoltre che l’outcome dei pazienti con carcinoma del colon stadio III, compresi i pazienti più anziani, arruolati negli studi di adiuvante e trattati con regimi basati sull’oxaliplatino, è migliorato dal 2004 in poi, per vari motivi:
- Migrazione di stadio come conseguenza di una più accurata stadiazione;
- Migliore gestione chirurgica e post-chirurgica dei pazienti;
- Aumentata aspettativa di vita.
Con la pubblicazione della “pooled analysis” della collaborazione internazionale IDEA che ha confrontato 3 versus 6 mesi di FOLFOX o CAPOX, è stato concluso che la durata della terapia adiuvante per lo stadio III del carcinoma del colon poteva essere ridotto a 3 mesi senza comprometterne i benefici, sottolineando come la riduzione della durata del trattamento riduce l’incidenza e la severità della neuropatia da oxaliplatino. In questa “pooled analysis” non è statotuttavia affrontato in maniera specifica l’effetto dell’età dei pazienti sull’outcome, né sono state fornite raccomandazioni sulla base dell’età.
In una post-hoc analisi del trial TOSCA comprendente 693 pazienti, è stato recentemente dimostrato in una analisi multivariata che il Time To Recurrence (TTR) non è stato significamente differente tra pazienti ≥ 70 anni e pazienti < 70 anni (HR = 1,19; p = 0,082) mentre la DFS, la OS e la sopravvivenza cancro specifica (Cancer-Specific-Survival = CSS) sono state significativamente ridotte nei pazienti ultrasettantenni (Rosati G., 2021).
Questa “pooled analysis” ACCENT/IDEA nasce pertanto dalla necessità di confrontare outcomes, quadri di tossicità e aderenza al trattamento della chemioterapia con oxaliplatino nei pazienti ≥ 70 anni e nei pazienti < 70 anni.
MATERIALI E METODI
Sono stati inclusi in questa analisi i dati di tutti i pazienti (derivanti dai databases ACCENT e IDEA) con carcinoma del colon stadio III assegnati a FOLFOX4, Mfolfox6 o CAPOX per 3 o 6 mesi. Sono stati valutati:
- Early treatment discontinuation (ETD), definito come l’interruzione dalla chemioterapia prima che i pazienti avessero ricevuto un massimo del 75% del numero di cicli di chemioterapia prespecificato dal protocollo;
- Early Oxaliplatin discontinuation (EOD), definita come l’interruzione da oxaliplatino prima che i pazienti avessero ricevuto almeno il 75% del numero di cicli pianificato con oxaliplatino pur continuando la terapia con fluoropirimidina;
- Time To Recurrence (TTR), definito come il tempo intercorso tra randomizzazione e ripresa di malattia;
- Disease-Free Survival (DFS) definita come tempo intercorso tra la randomizzazione e la ripresa di malattia o la morte per qualsiasi causa. Un secondo carcinoma del colon primario non è stato considerato un evento nella analisi della DFS e del TTR;
- Overall Survival (OS), definita come il tempo intercorso tra randomizzazione e morte per qualsiasi causa;
- Survival After Recurrence (SAR), definita come il tempo intercorso tra la prima ripresa di malattia e la morte per qualsiasi causa;
- Cancer-Specific Survival (CSS), definita come il tempo intercorso tra la randomizzazione e la morte correlata al cancro.
Sono state valutate le associazioni tra età e TTR, DFS, OS, SAR e CSS con modelli di COX stratificati in base agli studi e aggiustati per i fattori prognostici conosciuti: sesso, PS, pT, pN e anno di arruolamento.
RISULTATI
In questa “pooled analysis” sono stati inclusi 17.909 pazienti: 13.569 d’età < 70 anni (75,8%) e 4.340 ≥ 70 anni (24,2%). L’8,1% di pazienti aveva ≥ 75 anni (1.449).
I pazienti ≥ 70 anni erano più frequentemente di sesso maschile (57,7% vs 54,8%; p < 0,001) e con ECOG-PS ≥ 1 (29,5% vs 19,9%; p < 0,001), un BMI di 18,5-25 kg/m2 (46,5% vs 40,7% ; p < 0,001), tumori che erano più frequentemente T4 (21,2% vs 18,2% ; p < 0,001), localizzati nel colon prossimale (52,3% vs 41% ; p < 0,001), instabilità dei microsatelliti (15,8 % vs 10% ; p < 0,001) e mutazioni di BRAF V600E (18,3% vs 9,4% ; p < 0,001) rispetto ai pazienti < 70 anni di età.
Nella popolazione globale, i tassi di precoce interruzione del trattamento chemioterapico adiuvante (ETD) è stato più elevato nei pazienti ≥ 70 anni vs <70 anni (22% vs 15,5% ; p < 0,001). Anche l’interruzione dell’oxaliplatino (EOD) è stata più frequente nei pazienti ≥ 70 anni vs < 70 anni (42,4% vs 33,2% ; p < 0,001). Tali differenze sono risultate più frequenti nei pazienti sottoposti a 6 mesi di terapia.
I tassi di eventi avversi di grado ≥ 3 sono stati simili nei pazienti ≥ 70 anni vs < 70 anni, ad eccezione per diarrea e neutropenia che sono stati più frequenti nei pazienti più anziani trattati con CAPOX (14,2% vs 11,2% ; p = 0,01 per la diarrea; 12,1% vs 9,6% ; p = 0,04 per la neutropenia).
All’analisi multivariata, il tempo alla ripresa di malattia (TTR) non è stato significativamente differente nei pazienti < 70 anni e ≥ 70 anni, sia nei pazienti trattati per 3 mesi che per 6 mesi di chemioterapia adiuvante.
Sia nella analisi univariata che multivariata, la DFS, la OS, la sopravvivenza dopo la ripresa di malattia (SAR) e la sopravvivenza cancro-specifica (CSS) sono stati significativamente più brevi nei pazienti ≥ 70 anni sia nell’intera casistica sia analizzando separatamente i due gruppi di trattamento ( 3 mesi vs 6 mesi).
All’analisi multivariata, la TTR non era significativamente diversa tra i pazienti con età ≥70 anni e quelli con età <70 anni nella popolazione complessiva (HR= 1,05 [95% CI, da 0,98 a 1,12], p=0,18), nei pazienti trattati per 6 mesi (HR= 1,02 [95% CI, 0,94-1,12]; P=0,61), e in quelli trattati per 3 mesi (HR=1,10 [95% CI, 0,98-1,23]; p=0,10) (Tabella 1).
Al contrario, sempre nella popolazione complessiva, sono risultati significativamente più brevi nei pazienti di età ≥70 anni rispetto ai pazienti <70 anni:
la DFS (HR= 1,20 [95% CI, 1,13-1,28]; p < 0,001), OS (HR=1,44 [95% CI, 1,34-1,54]; p< 0,001),
la sopravvivenza dopo la ripresa di malattia (SAR) (HR=1,35 [95% CI, da 1,24 a 1,47]; p <0,001), e
la sopravvivenza cancro-specifica (CSS) (HR= 1,18 [95% CI, 1,07-1,30]; p ≤ 0,001).
Gli stessi risultati sono stati osservati nei pazienti trattati con i regimi a 6 mesi e a 3 mesi (Tabella 1).
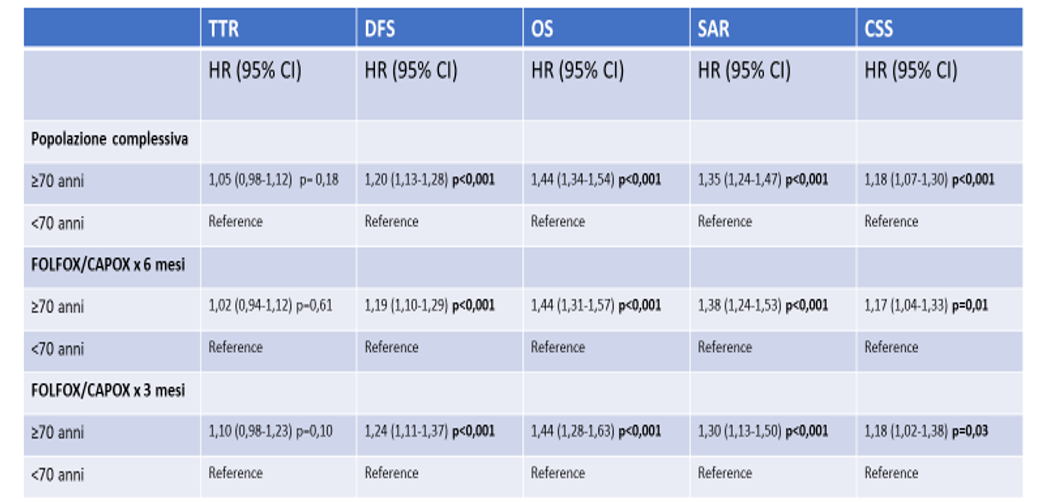
Tabella 1. Analisi multivariata per la sopravvivenza in base all’età.
TTR= Tempo alla ripresa i malattia; DFS= Disease Free Survival; OS= sopravvivenza globale;
SAR= sopravvivenza dopo la ripresa di malattia; CSS= la sopravvivenza cancro-specifica
Conclusioni
Ad oggi questo studio permette una analisi sui benefici terapeutici di un trattamento adiuvante contenente oxaliplatino nei pazienti di età ≥ 70 anni analizzando la più ampia casistica finora disponibile (oltre 17.000 pazienti).
Le analisi confermano la validità di un trattamento con oxaliplatino nei pazienti ≥ 70 anni in termini di TTR, a fronte di una riduzione in DFS, OS e di una aumentata tossicità rispetto ai pazienti < 70 anni. I risultati sono sovrapponibili nei due gruppi di trattamento (6 mesi e 3 mesi) sottolineando dunque che una riduzione della durata della chemioterapia adiuvante non rappresenterebbe una scelta detrimentale in termini di efficacia nei pazienti anziani, riducendo la tossicità.
Va sottolineato tuttavia che non si possono trarre conclusioni definitive sulla reale efficacia di una terapia combinata con oxalipatino versus la sola fluoropirimidina in quanto tutti i pazienti inclusi sono stati sottoposti a terapia combinata.
Bibliografia
- Impact of the IDEA Collaboration Study Results on Clinical Practice in France for Patients With Stage III Colon Cancer: A National GERCOR – PRODIGE Survey.Ouali K, Turpin A, Neuzillet C, Rousseau B, Garcia-Larnicol ML, Tournigand C, Samalin E, Taieb J, André T, Cohen R.Clin Colorectal Cancer. 2021 Mar;20(1):79-83.e4. doi: 10.1016/j.clcc.2020.11.004. Epub 2020 Nov 14.PMID: 33281064
- Petrelli F, Labianca R, Zaniboni A, Lonardi S, Galli F, Rulli E, Rosati G, Corallo S, Ronzoni M, Cardellino GG, Mattioli R, Mambrini A, Ciuffreda L, Banzi M, Pusceddu V, Maiello E, Zampino M, Zagonel V, Marchetti P, Corsi D, Rimassa L, Cinieri S, Sobrero AAssessment of Duration and Effects of 3 vs 6 Months of Adjuvant Chemotherapy in High-Risk Stage II Colorectal Cancer: A Subgroup Analysis of the TOSCA Randomized Clinical Trial. .JAMA Oncol. 2020 Apr 1;6(4):547-551. doi: 10.1001/jamaoncol.2019.6486.PMID: 32053133 Free PMC article.
- Domingo E, Kelly C, Hay J, Sansom O, Maka N, Oien K, Iveson T, Saunders M, Kerr R, Tomlinson I, Edwards J, Harkin A, Nowak M, Koelzer V, Easton A, Boukovinas I, Moustou E, Messaritakis I, Chondrozoumaki M, Karagianni M, Pagès F, Arnoux F, Lautard C, Lovera Y, Boquet I, Catteau A, Galon J; TransSCOT Consortium; Souglakos I, Church DN. Prognostic and Predictive Value of Immunoscore in Stage III Colorectal Cancer: Pooled Analysis of Cases From the SCOT and IDEA-HORG Studies. .J Clin Oncol. 2024 Jun 20;42(18):2207-2218. doi: 10.1200/JCO.23.01648. Epub 2024 Mar 14.PMID: 38484206 Free PMC article.
- FOLFOX and FLOX regimens for the adjuvant treatment of resected stage II and III colon cancer. Sharif S, O’Connell MJ, Yothers G, Lopa S, Wolmark N.Cancer Invest. 2008 Nov;26(9):956-63. doi: 10.1080/07357900802132550.PMID: 18798075 Free PMC article. Review.
Curr Opin Oncol. 2020 Jul;32(4):370-376. doi: 10.1097/CCO.0000000000000640.PMID: 32541327 Review.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/38547438/


