Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial
Wang-Gillam A, Li CP, Bodoky G, Dean A, Shan YS, Jameson G, Macarulla T, Lee KH, Cunningham D, Blanc JF, Hubner RA, Chiu CF, Schwartsmann G, Siveke JT, Braiteh F, Moyo V, Belanger B, Dhindsa N, Bayever E, Von Hoff DD, Chen LT; NAPOLI-1 Study Group.
Lancet. 2016 Feb 6;387(10018):545-557. doi: 10.1016/S0140-6736(15)00986-1. Epub 2015 Nov 29. Erratum in: Lancet. 2016 Feb 6;387(10018):536. PMID: 26615328.
La diagnosi di adenocarcinoma del pancreas viene posta solitamente quando la malattia è in stadio avanzato e la resezione chirurgica è impossibile: per tali motivi la sopravvivenza a 5 anni dalla diagnosi è intorno all’1-2%.
Le terapie standard di prima linea delle forme localmente avanzate e metastatiche sono oggi rappresentate da due regimi di combinazione:
-nab-paclitaxcl e gemcitabina;
-FOLFIRINO X (oxaliplatino, acido folinico, 5-fluorouracile, IRINOTECANO).
Irinotecano liposomiale è costituito da Irinotecano incapsulato in nanoparticelle liposomiali: questa formulazione aumenta i livelli intra-tumorali di irinotecano e del suo metabolita attivo (SN-38) e aumenta la duratya della sposizione delle cellule tumorali al farmaco rispetto a irinotecano standard.
In questo studio (NAPOLI-1) è stato valutato l’effetto dell’Irinotecano liposomiale in monoterapia oppure in combinazione con fluorouracile e acido folinico rispetto al fluorouracile e acido folinico (braccio di controllo) nei pazienti con adenocarcinoma al pancreas metastatico precedentemente trattato con terapia comprendente Gemcitabina ( in monoterapia o in combinazione).
METODI
In questo studio randomizzato di fase 3, open-label, internazionale, sono stati arruolati pazienti adulti (≥ 18 anni) affetti da adenocarcinoma duttale pancreatico metastatico con malattia in progressione dopo una precedente terapia basata su Gemcitabina somministrata nel setting neo-adiuvante, adiuvante (solo se le metastasi a distanza si erano verificate entro 6 mesi dal termine della terapia adiuvante), localmente avanzato o metastatico.
I pazienti dovevano avere un performance status sec. KARNOFSKY ≥ 70, una adeguata funzionalità ematologica, epatica (compresi valori normali della bilirubinemia totale e livelli di albuminemia ≥ 30 gr/L) e renale.
Sono stati arruolati anche pazienti precedentemente trattati con irinotecano e/o fluorouracile in associazione a gemcitabina.
I pazienti sono stati randomizzati (dopo emendamento dello studio) a ricevere (1:1:1):
-irinotecano nanoliposomiale + fluorouracile e acido folinico (irinotecano: 80 mg/mq in infusione endovenosa di 90 minuti seguito da acido folinico 400 mg/mq in 30 minuti e poi da fluorouracile 2.400 mg/mq in 46 ore- ogni 2 settimane)
-fluorouracile e acido folinico -braccio di controllo- (acido folinico 200 mg/mq in 30 minuti seguito da fluorouracile 2.000 mg/mq in 24 ore -ogni settimana x 4 settimane – cicli ripetuti ogni 6 settimane);
-irinotecano liposomiale (120 mg/mq/infusione IV di 90 minuti- ogni tre settimane).
In tutti i pazienti è stato eseguito test per il genotipo UGT1A1. La dose iniziale di irinotecano liposomiale è stata ridotta di 20 mg/mq per i pazienti con omozigosi per l’allele UGT1A1*28; irinotecano liposomaiale è poi stato somministrato alla dose standard dopo il primo ciclo in assenza di effetti collaterali correlati al farmaco.
Il trattamento veniva continuato fino a progressione o tossicità intollerabile.
L’end point primario era la sopravvivenza globale (OS) valutata nell’intention-to-treat population. L’analisi primaria è stata pianificata dopo 305 decessi.
La safety è stata valutata in tutti i pazienti trattati.
RISULTATI
Da gennaio 2012 a settembre 2013 sono stati randomizzati 417 pazienti:
-117 a irinotecano liposomiale + fluorouracile e acido folinico;
-149 a fluorouracile e acido folinico;
-151 a irinotecano liposomiale.
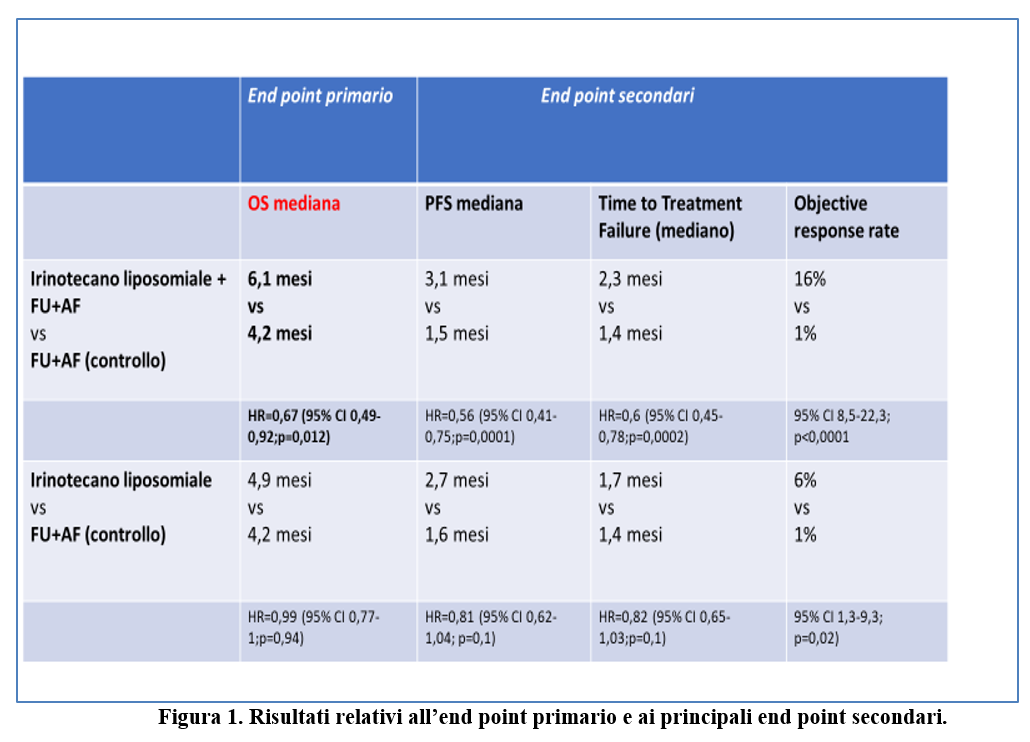
Dopo 313 eventi (decessi)alla data di cut off del 14 febbraio 2014, la OS mediana è stata pari a:
6,1 mesi (95% CI 4,8-8,9) nel gruppo Irinotecano liposomiale + fluorouracile e acido folinico vs 4,2 mesi (3,3-3,5) nel gruppo fluorouracile e acido folinico (HR stratificato 0,67; 95% CI 0,49-0,92; p=0,012);
4,9 mesi (95% CI 4,2-5,6) nel gruppo irinotecano liposomiale vs 4,2 mesi (3,6-4,9) nel gruppo fluorouracile e acido folinico (HR non stratificato= 0,99; 95% CI 0,77-1,28; p= 0,94).
Nella figura 1 sono riportati i risultati relativi alla sopravvivenza globale (OS) – end point primario- e ai principali end point secondari.
CONCLUSIONI
Irinotecano liposomiale in combinazione con fluorouracile e acido folinico aumenta la sopravvivenza globale nei pazienti con adenocarcinoma metastatico del pancreas pretrattati con terapia basata su gemcitabina, con un profilo di tossicità maneggevole, rappresentando quindi una valida opzione terapeutica.
COMMENTO
Sono circa 14.800 le nuove diagnosi di carcinoma del pancreas stimate per l’anno 2023 in Italia.
Solo un paziente su 5 risulta operabile al momento della diagnosi (Ilic M. et al, 2016). Nelle forme metastatiche trattate con terapia sistemica antitumorale la sopravvivenza mediana si attesta intorno a 11-12 mesi. La sopravvivenza a cinque anni è pari all’11% negli uomini e al 12% nelle donne.
L’adenocarcinoma pancreatico rimane l’unico tumore a non mostrare una riduzione dei tassi di mortalità negli ultimi anni in Europa (Amini M et al, 2023).
Questi dati sottolineano l’importanza della ricerca clinica.
In considerazione della scarsa vascolarizzazione e della presenza di uno strato stromale denso, è limitata la quantità di farmaci antiblastici che riesce a raggiungere le cellule tumorali. Per superare questa limitazione, è stata sfruttata la tecnologia delle nanoparticelle liposomiali che permette una maggiore distribuzione del farmaco all’interno dei tessuti tumorali. L’ irinotecano liposomiale peghilato, essendo inglobato in vescicole lipidiche (liposomi) che si accumulano in modo preferenziale nel tessuto tumorale, viene catturato dai macrofagi presenti nel microambiente con successiva liberazione del principio attivo, che può così raggiungere le cellule tumorali e bloccarne la replicazione.
Alla luce dei risultati dello studio registrativo NAPOLI-1, il farmaco antitumorale irinotecano liposomiale peghilato ha ottenuto la rimborsabilità da AIFA in Italia (Determina 20 novembre 2023) con la seguente indicazione terapeutica:
“trattamento dell’adenocarcinoma metastatico del pancreas in associazione con 5-fluorouracile (5-FU) e leucovorin (LV) in pazienti adulti in progressione dopo una terapia a base di gemcitabina”, pubblicata sulla Gazzetta Ufficiale n.281 dell’1-12-2023, scaricabile al LINK:
https://www.gazzettaufficiale.it/eli/gu/2023/12/01/281/sg/pdf
I vantaggi del farmaco sono stati evidenziati anche in uno studio italiano di real world evidence, recentemente pubblicato (Procaccio L et al, cancer Medicine 2023).
Inoltre, FDA in data 13 febbraio 2024 ha approvato irinotecano liposomiale in associazione a oxaliplatino, fluorouracile e acido folinicio anche per il trattamento di prima linea dell’adenocarcinoma del pancreas metastatico, alla luce dei risultati del trial NAPOLI-3 (Wianberg et al, Lancet 2023).
BIBLIOGRAFIA
Ilic M, Ilic I. Epidemiology of pancreatic cancer. World J Gastroenterol 2016; 22(44): 9694-9705 [PMID: 27956793 DOI: 10.3748/wjg.v22.i44.9694]
Amini M, et al. Global long-term trends and spatial cluster analysis of pancreatic cancer incidence and mortality over a 30-year period using the global burden of disease study 2019 data. PLOS ONE 18(7): e0288755. Published: July 20, 2023. https://doi.org/10.1371/journal.pone.0288755
Procaccio L et al. The role of nanoliposomal irinotecan plus fluorouracil/leucovorin in the continuum of care of patients with metastatic pancreatic ductal adenocarcinoma. Cancer Medicine 2023;12:14337–14345
https://onlinelibrary.wiley.com/doi/epdf/10.1002/cam4.6111
Wainberg ZA et al. NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. Lancet 2023; 402: 1272–81.
Open Access



