PD-L1 testing in metastatic triple-negative breast cancer: Interobserver and interplatform reproducibility of CE-IVD assays for CPS and IC scores
Ivanova M, Frascarelli C, Cerbelli B, Pignataro MG, Pernazza A, Venetis K, Sajjadi E, Criscitiello C, Curigliano G, Guerini-Rocco E, Graziano P, Martini M, d’Amati G, Fusco N.
Hum Pathol. 2024 Feb;144:22-27. doi: 10.1016/j.humpath.2024.01.008. Epub 2024 Jan 24. PMID: 38278450.
L’analisi di PD-L1 svolge un ruolo essenziale per guidare la selezione delle pazienti idonee all’immunoterapia
nel carcinoma mammario metastatico triplo-negativo (mTNBC). Si tratta di un test basato sull’immunoistochimica (IHC) che viene effettuato su tessuto tumorale, per il quale sono disponibili diversi assay e piattaforme, ciascuno con i propri sistemi di score. Nel caso del mTNBC può essere utilizzato sia il combined positive score (CPS) che l’immune cell score (IC).
Questi score hanno valori soglia specifici che determinano l’eleggibilità di una paziente a diversi agenti terapeutici: un IC ≥ 1 % identifica le pazienti candidabili ad atezolizumab e un CPS≥10 identifica le pazienti candidabili a pembrolizumab (Figura 1).
Questi test, sebbene si basino sul medesimo biomarcatore, sono dunque profondamente diversi e rappresentano delle nuove analisi nella patologia oncologica mammaria.
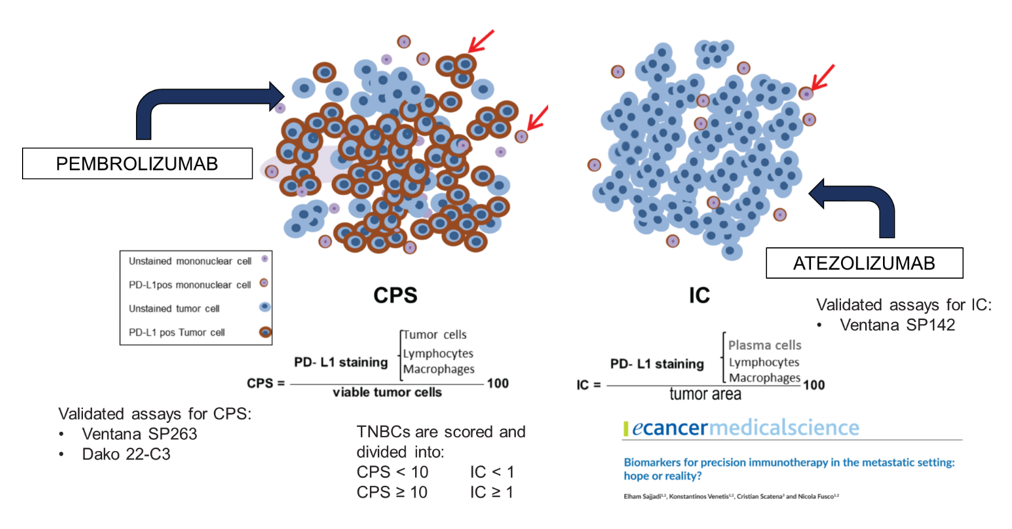
Figura 1. Modalità di test PD-L1 nel carcinoma della mammella triplo-negativo. Ciascun test, Combined positive score (CPS) e Immune cell (IC) score, ha differenti indicazioni terapeutiche, differenti metodologie di calcolo, differenti valori di cut-off e differenti assay validati.
Benché il test PD-L1 22C3 su piattaforma Dako sia stato il test diagnostico di accompagnamento (companion diagnostic) negli studi KEYNOTE, diversi lavori di validazione analitica hanno convalidato la riproducibilità del test PD-L1 SP263 su piattaforma Ventana nella determinazione del CPS in vari tipi di tumore, tra i quali il carcinoma a cellule squamose della testa e del collo.
Di conseguenza, sia 22C3 che SP263 rappresentano dei test certificati (certificazione della Comunità Europea per i dispositivi medico-diagnostici in vitro- CE-IVD) per il CPS, sebbene quest’ultimo non sia ancora stato specificamente validato nel mTNBC.
Inoltre, il test SP142 di Ventana è l’unico a tutt’oggi validato per lo score IC e dunque approvato per atezolizumab nel mTNBC.
Quindi in questo momento la situazione è questa: per il calcolo di IC abbiamo a disposizione l’SP142 come unico test validato, per identificare pazienti candidabili a terapia con atezolizumab.
Invece, per il calcolo del CPS – per identificare pazienti candidabili a terapia con pembrolizumab- abbiamo a disposizione due test differenti per il PD-L1: il test 22C3 su piattaforma DAKO e il test SP263 su piattaforma Ventana. Il test SP263 su piattaforma Ventana non è stato ancora analiticamente armonizzato con il test di riferimento 22C3 nel mTNBC.
Questo vuol dire che i laboratori di anatomia patologica che dispongono della sola piattaforma Ventana, per effettuare il calcolo del CPS nel mTNBC, devono procedere a delle validazioni interne del loro test SP263.
La Figura 2 mostra i risultati di una survey nazionale che dimostra la grande eterogeneità di assay e piattaforme disponibili in 128 laboratori di Anatomia Patologica italiani che effettuano il test PD-L1 nel carcinoma della mammella triplo-negativo.
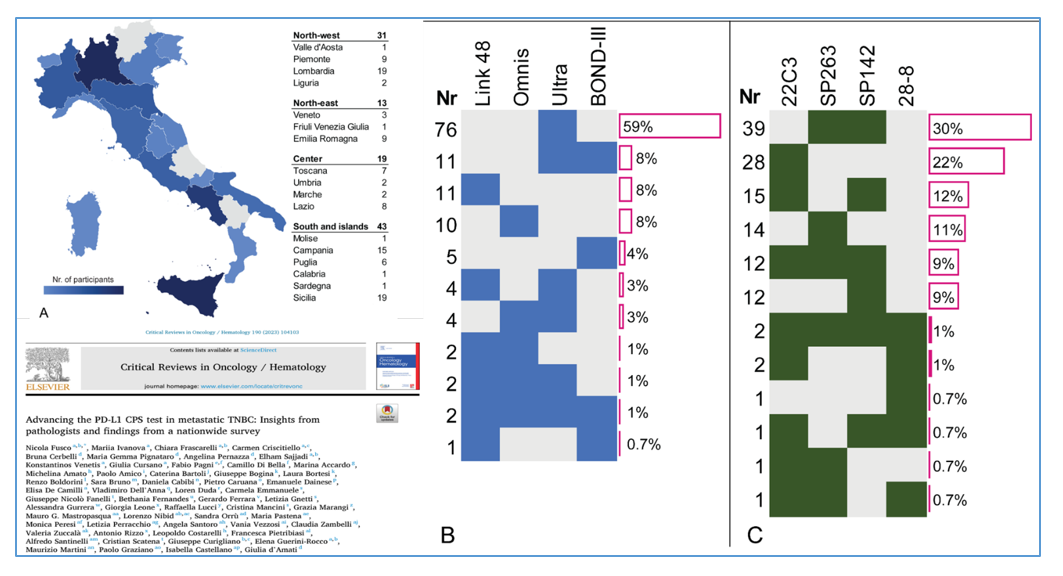
Figura 2. Panoramica di un’indagine nazionale condotta nei laboratori di patologia sul test PD-L1 CPS per il carcinoma mammario triplo negativo metastatico (mTNBC). A. Distribuzione dei 128 centri partecipanti in Italia. B. Disponibilità di piattaforma. C. Disponibilità dello specifico assay.
In questa situazione alquanto complessa, la scelta del test e della piattaforma, insieme alle specifiche metodologie di score, influenzano in modo significativo i risultati delle valutazioni PD-L1 nel mTNBC.
L’obiettivo di questo studio è stato quello di caratterizzare la riproducibilità tra patologi e tra i differenti tipi di test PD-L1 nel mTNBC, per confrontare la loro efficacia diagnostica e validità analitica.
MATERIALI E METODI
Questo lavoro multicentrico osservazionale retrospettivo ha valutato 60 pazienti con mTNBC sottoposte a biopsia o resezione chirurgica.
Tutti i casi avevano un precedente test PD-L1 eseguito con il 22C3 e sono stati selezionati in base a un valore CPS intorno alla soglia (intervallo CPS = 5-20). Le analisi sono state condotte da cinque patologi esperti in valutazioni di PD-L1 con entrambi i test 22C3 e SP263 per il CPS, e da tre di questi cinque patologi esperti in patologia mammaria per la valutazione del PL-l1 con il test SP142 per l’IC. I campioni analizzati comprendevano 28 (47%) biopsie e 32 (53%) campioni chirurgici di pazienti con mTNBC diagnosticati tra il 2020 e il 2023 (range di età 24-90 anni; media = 58 anni). Tra i campioni selezionati, 29 (48 %) casi sono stati raccolti dai tumori primari dei pazienti, 30 (50 %) casi da siti metastatici e il restante (2 %) dal sito di recidiva. Le sedi metastatiche comprendevano cute, tessuti molli, pleura, polmone, fegato, linfonodi e osso (sterno).
Dopo aver calcolato il coefficiente ICC (Intraclass Correlation Coefficient) per ciascun test e le rispettive soglie, è stato valutato l’accordo tra i diversi valutatori e i test utilizzando il coefficiente di Fleiss (Fleiss’s κ) con un intervallo di confidenza (CI) del 95%.
RISULTATI
Utilizzando un cut-off CPS del 10%, con il test 22C3 il 40% (n= 24) dei campioni sono stati classificati come positivi a PD-L1, mentre il 55% (n=33) casi sono stati valutati come negativi da tutti e cinque i patologi.
Utilizzando sempre un cut-off del 10%, con il test SP263 il 38% (n= 23) dei casi sono stati considerati PD-L1 positivi e il 58% (n=35) sono stati considerati PD-L1 negativi da tutti e cinque i patologi.
Da notare che in 22 (37 %) campioni, i risultati erano congruamente positivi e in 32 (53 %) campioni negativi per entrambi i test da parte di tutti e cinque i patologi.
Utilizzando un cut-off dell’1% per l’IC score, il 53% (n=10) dei campioni sono stati giudicati PD-L1 positivi e il 37% (n=7) PD-L1 negativi con il test SP142.
Confrontando 22C3 e SP263, c’è stato un accordo tra i patologi in termini di positività CPS del 93% per il test 22C3 e del 90% per il test SP263.
L’accordo tra patologi per il punteggio IC, valutato con il test SP142, è stato del 100%.
È stata osservata un’affidabilità inter-osservatore significativa (p < 0,001) tra i patologi per i punteggi continui di CPS, con un ICC (Intraclass Correlation Coefficient) di 0,939 (95 % CI 0,913-0,96) per il test 22C3 e di 0,972 (95 % CI 0,96-0,982) per il test SP26.
Il coefficiente di Fleiss ( Fleiss’s κ) ha confermato un accordo quasi perfetto tra patologi e test:
22C3 = 0,938 (CI:0,857-1,018);
SP263 = 0,972 (CI:0,890-1,052);
combinazione 22C3-SP263 = 0,907 (CI:0,869-0,945).
Per il dosaggio SP142 è stata raggiunta una perfetta concordanza tra i patologi (ICC = 1, 100 % di concordanza).
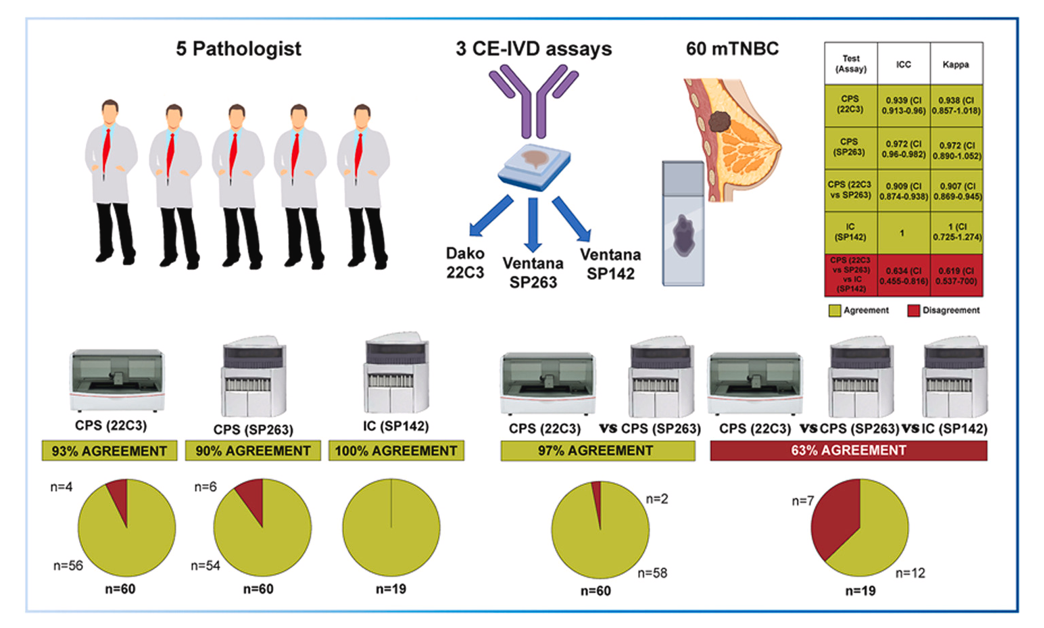
Figura 2. Disegno dello studio e risultati. Il Combined Positive Score (CPS) può essere determinato in modo affidabile sia attraverso l’utilizzo del test 22C3 sia mediante il test SP263, purché i) il test sia eseguito da patologi con esperienza in carcinoma della mammella che abbiano ricevuto un training mirato per PD-L1 e ii) che ciascun test sia eseguito sulla sua piattaforma specifica, vale a dire il test 22C3 su Dako e il test SP263 su Ventana. Le valutazioni di PD-L1 mediante CPS e IC identificano sottogruppi distinti di pazienti.
CONCLUSIONI
Questo è il primo studio di validazione analitica che dimostra che nel mTNBC, il CPS può essere determinato in maniera affidabile sia utilizzando il test 22C3 (piattaforma Dako) -come negli studi KEYNOTE- che utilizzando il test SP263 (piattaforma Ventana).
È fondamentale che ogni test venga utilizzato sulla piattaforma dedicata, in particolare Dako per il 22C3 e Ventana per l’SP263.
Viene inoltre confermato che anche nel mTNBC le valutazioni del PD-L1 secondo CPS e IC NON sono intercambiabili perché identificano sottopopolazioni distinte di pazienti.


